Introducción
La fermentación, es históricamente un medio útil para la conservación de los alimentos. Actualmente, a esta técnica se le ha otorgado más atención porque la mayoría de los nuevos productos alimenticios son saludables y con propiedades sensoriales agradables (Frias, Martinez-Villaluenga & Peñas, 2017; Taboada-Ramírez, 2018; Wacher-Rodarte, 2014). Los alimentos, entre ellos las bebidas fermentadas son procesados mediante un crecimiento microbiano controlado en conjunto con los cambios enzimáticos de los componentes primarios y secundarios que los conforman (Cuvas-Limon et al., 2020). En México, se producen una gran variedad de bebidas fermentadas muy ligadas a las tradiciones, y cultura de una región por consumirse desde la época prehispánica. El proceso para su preparación las divide en: a) destilados: tequila, lías, mezcal, bacanora y sotol; b) no destilados: pulque, tejuino, tepache, colonche, pozol, tuba, axokot y taberna (De La Fuente-Salcido et al., 2015). La preparación de las bebidas tradicionales se produce mediante un proceso de fermentación espontánea, afectado por la microbiota contenida en la materia prima y por los factores ambientales que pueden o no beneficiarlo, además de considerar el grado de acidez y de etanol del producto final (Villarreal-Morales, Montañez -Saenz, Aguilar-González & Rodriguez -Herrera, 2018). Es importante, definir que la microbiota es el conjunto de microorganismos (bacterias, hongos, arqueas, virus y parásitos) que reside en un entorno definido, que a su vez pueden diferenciarse en comensales, mutualistas y patógenos, por otra parte, el término microbioma hace referencia a todo el hábitat, incluidos los microorganismos, sus genes y las condiciones ambientales, pero en la práctica ambos términos se usan indistintamente (Del Campo-Moreno, Alarcón-Cavero, D’Auria, Delgado-Palacio & Ferrer-Martínez, 2017). La fermentación, además de llevarse a cabo por la comunidad microbiana natural o espontánea, también puede realizarse por retroceso, en el que una pequeña cantidad del fermentado anterior sea utilizado como inóculo para la siguiente etapa de fermentación, o mediante la adición de cultivos que la inicien o iniciadores. La fermentación espontánea, la materia prima y el tratamiento inicial, favorecerán el crecimiento de una microbiota denominada autóctona o nativa, en la cual se hace referencia a la microbiota constituida por el conjunto de microorganismos que colonizan establemente una superficie (epidermis y mucosas en el cuerpo humano)(Suárez, 2013; Liburdi, Bernini & Esti, 2020). Los alimentos fermentados de tipo tradicional son considerados como una fuente de nutrientes, además de que contienen residuos de sustratos y levaduras, entre otros microorganismos, que les confieren un mayor valor nutricional (Lacerda-Ramos & Freitas-Schwan, 2017). En algunas bebidas fermentadas, se asocia el contenido microbiano con una notoria mejoría en la salud gastrointestinal. Aunque, a veces no está claro qué características funcionales contienen las bebidas tradicionales, más allá de la nutrición básica de los ingredientes crudos no fermentados, existen pruebas de que algunas bebidas fermentadas proporcionan efectos benéficos a través de la acción microbiana/probiótica al producir metabolitos y por desnaturalización de proteínas complejas (Marsh, Hill, Ross & Cotter, 2014). El objetivo de esta revisión es destacar la información disponible de cuatro bebidas seleccionadas, los probióticos presentes en ellas, el mecanismo de acción de estos y sus posibles aplicaciones en la salud humana. Los estudios realizados a los probióticos en bebidas tradicionales fermentadas aún son escasos, por lo que esta revisión reúne la información científica disponible sobre ellos en las bases de datos como: Pubmed, Science Direct, Web of Science, SciELO, Redalyc, Dialnet, Springer y Google Academico; la búsqueda se inició con las palabras clave: “prebiótico”, “probiótico”, “pulque”, “bebidas tradicionales en México”, “tuba”, “pozol”, “tepache”, “biomedicina” y “microbiota intestinal”.
Mecanismo de acción de los probióticos
La palabra “probiótico” se deriva del griego y significa “pro vida”. La Organización Mundial de la Salud (OMS) y la Organización de las Naciones Unidas para la Agricultura y Alimentación (FAO) definen a los probióticos como “organismos vivos que al ser administrados en raciones adecuadas confieren un beneficio a la salud del hospedero” (Márquez-Villalobos, López-Lemus, Reyes-Escogido & Ramírez-Emiliano, 2017). También, los probióticos pueden definirse como suplementos dietéticos que contienen cepas microbianas vivas capaces de persistir (o colonizar transitoriamente) en el tracto intestinal humano, mejorando la salud al conferir una influencia benéfica sobre la fisiología del hospedero. Este proceso, es particularmente importante cuando se ha alterado la microbiota nativa normal: es en ese momento, cuando un suplemento exógeno de probióticos de una especie/cepa al colonizar temporalmente el tracto intestinal estabiliza la composición de la microbiota original, restaurando la función fisiológica vital, convirtiéndose en una microbiota comensal (Sharifi-Rad et al., 2020; Sing, Sharma, Babu & Singla, 2013) . Se ha determinado que los efectos benéficos de los probióticos se producen a través de diversos mecanismos de acción (Figura 1) que incluyen: (a) Bloqueo de la adhesión de bacterias patógenas, (bacterias que poseen la capacidad de producir un daño, a cualquier nivel, en un organismo hospedero susceptible), al epitelio intestinal mediante el descenso: del pH intestinal, de la producción de metabolitos y de agentes inhibidores entre los que destacan los ácidos grasos libres, los péptidos antibacterianos, el ácido láctico y agentes oxidantes como el peróxido de hidrógeno; (b) Supresión del crecimiento de las bacterias patógenas mediante la unión directa a las bacterias gramnegativas inhibiendo la invasión bacteriana y bloqueando la adhesión y translocación de los patógenos al epitelio; (c) Mantenimiento de los niveles normales de ácidos grasos de cadena corta (AGCC): Los productos de la actividad metabólica de los probióticos como el etanol, lactato, acetato, ácido fólico, piruvato y succinato, pueden ser metabolizados para producir AGCC, que influyen en el metabolismo, proliferación y apoptosis de las células epiteliales. Se ha demostrado, en experimentos in vitro que estas moléculas inhiben la proliferación celular e incrementan la apoptosis de células malignas (Suez, Zmora, Segal & Elinav, 2019; Reyes-Esparza & Rodríguez-Fragoso, 2012; Medina-Torres, Espinosa-Padilla, Camacho-Castillo & Carvajal-Aguilera, 2014); (d) Mejoría en la respuesta inmune intestinal y supresión de la liberación de citocinas proinflamatorias que facilitan el desarrollo y el mantenimiento de una respuesta inflamatoria crónica del intestino. Los mecanismos de interacción de los probióticos con las células del sistema inmune son diversos. En el caso de las bacterias ácido lácticas, se ha observado que son captadas por las células M presentes en el epitelio y facilitan la estimulación del tejido linfoide asociado a la mucosa intestinal. Las células dendríticas capturan bacterias probióticas con sus prolongaciones citoplasmáticas que acceden al espacio luminal. Muchos de los efectos inducidos por los probióticos dependen de la interacción del microorganismo con la célula dendrítica (CD), por la capacidad que tiene de polarizar la respuesta inmune adaptativa (Manzano, Estupiñan & Poveda, 2012). Las funciones del epitelio intestinal son reguladas por los probióticos mediante las vías de señalización intracelular específicas, como las proteínas quinasas activadas por mitógenos (MAPK) y el factor nuclear kappa b (NF-κB) en las células epiteliales intestinales (Yan & Polk, 2020). Las cepas probióticas tienen una influencia significativa sobre la barrera intestinal al estimular las células B para la producción de inmunoglobulina A (IgA) que es la primera línea de defensa frente a la infección, mediante la inhibición de la adhesión bacteriana y viral a las células epiteliales, así como la neutralización de las toxinas bacterianas y víricas. En estudios in vitro con células de enterocitos (HT-29, caco -2 y CD), se ha reportado que los probióticos también influyen en la producción de citocinas a través de células presentadoras de antígeno (APC), que inicia una respuesta adaptativa. La relación de la activación de esta APC con la producción de las citocinas depende del tipo de cepa del probiótico, observándose casos de inhibición o estimulación de la producción de las citocinas interleucina- 10 (IL-10) e interleucina-12 (IL-12) lo que favorece un estado de tolerancia o una respuesta inmune Th1 respectivamente, al considerar que el proceso inflamatorio depende de las citocinas proinflamatorias y las antiinflamatorias, donde la citocina antiinflamatoria IL-10, es producida por monocitos, células T, células asesinas naturales (NK) y CD, que inhiben a las citocinas proinflamatorias, quimiocinas y receptores de quimiocinas, responsables de la inflamación intestinal (Azad, Sarker & Wan, 2018; Manzano, Estupiñan & Poveda, 2012); (e) Reparación de la permeabilidad intestinal: Los probióticos poseen la capacidad de adherirse a los enterocitos y a los colonocitos afectando a la composición del ecosistema intestinal e incrementando el efecto barrera no dependiente del sistema inmunológico Las uniones estrechas entre las células de la mucosa son fundamentales para evitar la entrada de patógenos a la circulación. La modificación en la expresión y la redistribución de las uniones estrechas reduce la permeabilidad intestinal limitando la absorción de moléculas nocivas (Tormo-Carnicé, 2006; Reyes-Esparza & Rodríguez-Fragoso, 2012); (f) Regulación de la absorción intestinal de electrolitos: La regulación es posible por el aumento de la superficie intestinal de absorción, a las dimensiones de las microvellosidades y a su renovación, lo que permite una mejor absorción (Cabrera-Cao & Fadragas-Fernández, 2005); (g) Regulación del metabolismo de los lípidos: Existen estudios experimentales que demuestran un efecto benéfico del consumo de probióticos en el metabolismo de los lípidos (disminución de los niveles de colesterol y lipoproteínas de baja densidad, así como un aumento en los niveles de lipoproteínas de alta densidad) (Manzano, Estupiñan & Poveda, 2012). Alguno de los mecanismos propuestos llega a influir en el descenso del colesterol por ingesta de probióticos, con la subsecuente disminución de la actividad de la betahidroximetil glutaril-CoA hepática se inhibe la síntesis del colesterol. Otro mecanismo, estaría mediado por el estímulo en la formación de AGCC, propionatos y butiratos que se inducen en el intestino grueso, se absorben y pasan directamente al torrente sanguíneo. El acetato, aumenta los niveles de colesterol en sangre y disminuye los valores de ácidos grasos, mientras que el propionato aumenta los niveles de glucosa en sangre y disminuye la respuesta hipercolesterolémica del acetato (Tormo-Carnicé, 2006). La efectividad de estos mecanismos dependen de varios factores como la resistencia a la colonización patógena, la estimulación de la fagocitosis, la producción de compuestos antimicrobianos, los efectos antimutagénicos, la producción de quimiocinas y el impacto en la actividad enzimática intraluminal (el equipo enzimático de los probióticos metaboliza componentes nutricionales que no pueden ser metabolizados por el hospedero, como los α-galactooligosacáridos (actividad de α-galactosidasa), inulina (atribuido al gen inuJ que codifica para una inulosucrasa), almidones resistentes y factores anti nutricionales (como los taninos) (Cárdenas-Perea, Cruz y López, Gándara-Ramírez & Pérez-Hernández, 2014; Suez, Zmora, Segal & Elinav, 2019; Zommiti, Feuilloley & Connil, 2020; Iñiguez-Palomares, Bolado-Martínez & Acedo-Félix, 2010). El uso de cepas bacterianas en los suplementos y alimentos probióticos está enfocado de acuerdo a las propiedades que se han encontrado de manera experimental como: la reducción del peso corporal, presión arterial sistólica, las lipoproteínas de baja densidad (LDLc), de la colonización en el tracto intestinal, respiratorio y urogenital, de la carcinogénesis, de la absorción del calcio y del potencial de síntesis de vitaminas, reductor de las levaduras y de la infección vaginal al estabilizar la microbiota vaginal, de la tasa de estreñimiento y de los trastornos diarreicos, de la gastritis y las úlceras, reducción del acné, de la dermatitis atópica, y la producción de antimicrobianos naturales (Agerholm-Larsen, Raben, Haulrik, Hansen, Manders & Astrup, 2000; Vasiljevic & Shah, 2008; Manzano, Estupiñan & Poveda, 2012; Vieira, Teixeira & Martins, 2013; Russo, Karadja & De Seta, 2019; Rather, Bajpai, Kumar, Lim, Paek & Park, 2016; Zommiti, Feuilloley & Connil, 2020; Valdovinos et al., 2017).

Figura 1 Mecanismos de acción de los probióticos a nivel de enterocitos. Modificado de (Olveira & González-Molero, 2016).
Principales bebidas, fermentadas, tradicionales mexicanas
En México, se producen diversas bebidas fermentadas a partir de una amplia gama de: cereales (maíz, cebada y trigo), frutos (manzana, piña, tamarindo, tuna y cacao) y plantas (palma de coco (Coccos nucifera), palma de coyol (Acrocomia aculeata) y diversas especies de agaves (Agave angustifolia Haw, Agave cupreata Trel. & Berger, Agave filifera Salm-Dyck, Agave hookeri Jacobi, Agave inaquidens K. Koch, Agave salmiana Otto ex Salm-Dyck, Agave schidigera Lem, Agave tequilana Weber, Agave karwinskii y Agave potatorum) (Vilela, Cosme & Inês, 2020; Pérez-Hernández, Chavez-Parga & González-Hernández, 2016), debido a diversos factores como: ubicación, relieves extremos y ecosistemas contrastantes (Ramírez-Guzmán et al., 2019). A continuación, se describen las bebidas fermentadas no destiladas, producidas y consumidas en el país, que han sido objeto de estudio para demostrar su capacidad como probióticos (Tabla I) y aplicaciones biomédicas (Figura 2):
Tabla I Cepas de microorganismos probióticos aislados de bebidas fermentadas tradicionales mexicanas y sus posibles aplicaciones biomédicas.
| Bebida | Cepas Aisladas | Aplicaciones | Referencias |
|---|---|---|---|
| Pulque | Leuconostoc mesenteroides subsp. Mesenteroides SD23 | Mejora la disfunción metabólica asociada a la obesidad. Reducción del peso corporal, niveles de glucosa, colesterol y leptina (modelo murino). | Castro-Rodríguez et al., 2020 |
| Cepas de los géneros Lactobacillus y Pediococcus | Importante actividad antibacteriana contra H. pylori ATCC43504, E. coli ATCC 25922, S. aureus ATCC 29213. Potencial preventivo para las infecciones bacterianas multirresistentes | Cervantes-Elizarrarás et al., 2019 | |
| Leuconostoc mesenteroides P45 | Efecto antagónico contra la cepa L1334 de S. enterica serovar, Typhimurium resistente a la estreptomicina (modelo murino). | Giles-Gómez et al., 2016 | |
| Lactobacillus sanfranciscensis LBH1068 | Propiedades antiinflamatorias, reducción de la pérdida de peso, disminución de la permeabilidad intestinal y modulación de las citocinas (modelo murino). | Torres-Maravilla et al., 2016 | |
| Lactobacillus casei J57 | Actividad hidrolasa de sales biliares. Reducción potencial del colesterol. | González-Vázquez et al., 2015 | |
| Tuba | Lactococcus lactis TuAB1 y Enterococcus faecium TuAB2 | Actividad antimicrobiana debido a la producción de bacteriocinas. | De La Fuente-Salcido et al., 2015 |
| * no aplica | Actividad antioxidante, eliminación de especies reactivas de oxígeno y protección al DNA. | Chen et al., 2011 | |
| * no aplica | Auxiliar en el tratamiento de enfermedades gastrointestinales. | Astudillo-Melgar et al., 2019 | |
| Pozol | Streptococcus sp. | Capacidad de colonizar el epitelio gastrointestinal, faríngeo y cervical (en células cultivadas in vitro). | Chavarin NL, 2015 |
| Bacillus sp. CS93 | Producción de lipopéptido antifúngico iturina A, y los compuestos antibacterianos bacilysina y clorotetaína. | Moran et al., 2010 | |
| Weisella confusa | Síntesis de exopolisacáridos con potencial de fibra soluble o prebiótico. | Hernández-Oaxaca et al., 2021 | |
| Leuconostoc citreum CW28 | Producción de inulina de alto peso molecular, para la obtención de oligosacáridos con función prebiótica. | Olvera et al., 2017 | |
| Bacterias Ácido Lácticas (no especificadas) | Evidencia de potencial probiótico por resistencia a condiciones gastrointestinales simuladas. | Velázquez-López et al., 2018 | |
| *no aplica | Auxiliar en el tratamiento de enfermedades gastrointestinales y lesiones cutáneas. | Phister et al., 2004; Wacher Rodarte, 2014 | |
| Tepache | Lactobacillus pentosus ABHEAU-05 | Evidencia de potencial probiótico por resistencia a condiciones gastrointestinales simuladas. | Escobar-Ramírez et al., 2020 |
| Lactococcus lactis TeA1 y Enterococcus faecium TeA2 | Evidencia de posible actividad antimicrobiana, desarrollo de péptidos por bacteriocinas. | De La Fuente-Salcido et al., 2015 | |
| Leuconostoc mesenteroides | Producción de bacteriocinas y dextranos. | Romero-Luna et al., 2017 | |
| Enterococcus malodoratus | Actividad antibacteriana por bacteriocinas, inhibiendo a K. pneumoniae, | Pérez et al., 2016 |
*no aplica: se refiere a que el beneficio no ha sido adjudicado a determinadas cepas.
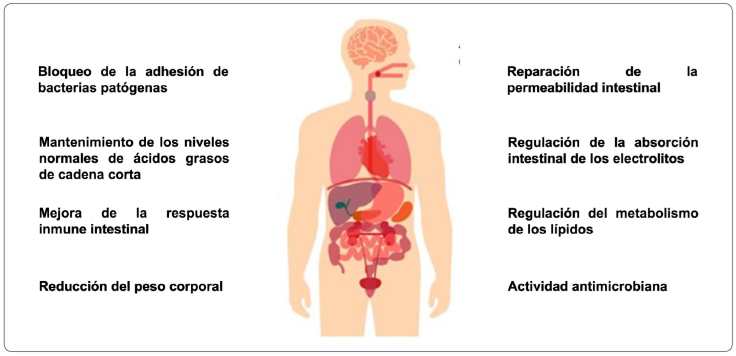
Figura 2 Propiedades benéficas de las bebidas fermentadas mencionadas (Bovell-Benjamin, 2010; Astudillo-Melgar et al., 2019; Phister et al., 2004; Wacher Rodarte, 2014; Martínez-Cervantes et al., 2019).
● Pulque
El pulque, es una bebida de color blanco lechoso, viscosa y ligeramente ácida que posee un contenido alcohólico variable (4-7°GL), producido por fermentación espontánea del aguamiel (Escalante et al., 2016). Las principales especies de donde se obtiene son: el maguey manso o maguey verde (A. salmiana var. salmiana Otto ex Salm-Dyck), el maguey de mano larga o maguey mexicano (A. mapisaga Trelease), el maguey blanco (A. atrovirens Karw) y en algunas ocasiones se utilizan a los A. americana y a los A. ferox. Estas especies se encuentran distribuidas en el Estado de México, Querétaro, Puebla, Tlaxcala e Hidalgo y en menor proporción en: Veracruz, Oaxaca y Zacatecas (Lappe-Oliveras et al ., 2008). El proceso comienza con la selección de las plantas que tienen entre 6 y 15 años próximas a florecer, es entonces cuando el capullo floral se corta haciendo un agujero en su tallo central, creando en el interior una cavidad para contener dos litros de aguamiel. La superficie de la cavidad se raspa para facilitar la producción de una savia líquida conocida como aguamiel, la cavidad se “sella” con rocas, hojas o bolsas de plástico para brindar cierto grado de protección contra animales, insectos y un ambiente que de otra manera sería séptico (Valadez-Blanco, Bravo-Villa, Santos-Sánchez, Velasco-Almendarez & Montville, 2012). El “tlachiquero”, que es la persona encargada de todo el proceso, recolecta el aguamiel dos veces al día (Valadez-Blanco, Bravo-Villa, Santos-Sánchez, Velasco-Almendarez & Montville, 2012). La recolección es de entre 4 a 6 meses, con una producción aproximada de más de 1,000 litros (de 4 a 6 litros al día); finalizando este periodo, la planta muere (Escalante, López-Soto, Velázquez-Gutiérrez, Giles-Gómez, Bolívar & López-Munguía, 2016). Después el producto es transportado al tinacal o tina, que puede ser de madera, arcilla o más común de plástico, donde se lleva a cabo la fermentación (Escalante, López-Soto, Velázquez-Gutiérrez, Giles-Gómez, Bolívar & López-Munguía, 2016) que da lugar al pulque. La fermentación puede ser iniciada por la microbiota residente, usando un procedimiento similar al de una fermentación por lotes; se agrega aguamiel a la tina, preparada para mantener un volumen constante, y se obtiene el pulque listo para su consumo (Valadez-Blanco, Bravo-Villa, Santos-Sánchez, Velasco-Almendarez & Montville, 2012). Alternativamente, el pulque de un lote anterior, se agrega al recipiente de fermentación como inóculo para el siguiente lote, para ello se vierten de 10 a 15 L de aguamiel en una tina con capacidad para 1,000 L y se le adiciona una porción del pulque previamente fermentado. La primera fermentación se logra en una semana en verano o cuatro semanas en invierno, hasta que son detectados los sabores alcohólicos, acéticos y la presencia de un sobrenadante blanco llamado “zurrón”. Posteriormente, se llena la totalidad del volumen de la tina con aguamiel fresco hasta que fermente agitando con frecuencia y cuando aparece el zurrón, este se retira. Con esto se obtiene el inóculo iniciador que se vacía en otras tinas para repetir el proceso (Escalante, López-Soto, Velázquez-Gutiérrez, Giles-Gómez, Bolívar & López-Munguía, 2016). Entre las bebidas derivadas del maguey, el pulque es la bebida alcohólica tradicional mexicana más antigua (Escalante et al., 2012). Su consumo con fines ceremoniales se remonta a la época precolombina. La segunda mitad del siglo XIX y principios del XX fueron los periodos de su mayor producción, comercialización y consumo (Rojas-Rivas & Cuffia, 2020). En el año 2013, la producción alcanzó los 504 millones de litros, sin embargo, en los últimos años, ha disminuido significativamente, el año 2020 marca la diferencia con 167.22 millones de litros, probablemente por los problemas actuales de salud mundial (Rojas-Rivas, Viesca-González, Favila-Cisneros & Cuffia, 2020; SIAP, 2020). El pulque está presente en diferentes eventos impulsados por jóvenes que lo promueven, y la participación de los consumidores, con actividades como: los ‘‘tours del pulque en la Ciudad de México’’, las ferias agroalimentarias, la creación del Congreso Nacional del Pulque, para resurgir como la ‘’neo cultura del pulque’’ (Rojas-Rivas & Cuffia, 2020). El pulque, es una bebida de bajo contenido alcohólico, se considera un suplemento nutricional, al aportar vitaminas y minerales como la tiamina, la riboflavina, la niacina, la vitamina C, el calcio y el hierro (Bovell-Benjamin, 2010; Chacón-Vargas, Torres, Giles-Gómez, Escalante & Gibbons, 2020). Las propiedades biomédicas del pulque son: una mejoría en los trastornos gastrointestinales, e infecciones renales (Bovell-Benjamin, 2010). La fermentación del pulque, se debe a la intervención de microorganismos clasificados de acuerdo a los tres rasgos metabólicos distintivos en el producto (Escalante et al., 2004; Escalante et al., 2016) y son: (a) las bacterias del ácido láctico, (b) las bacterias del ácido acético que producen la acidez característica, oscilando en un pH de entre 3.5-4.2 y (c) las levaduras, que al metabolizar a los azúcares se produce el etanol (Saccharomyces sp. y Kluyveromyces sp.) y de la bacteria Zymomonas mobilis. Especies del género de bacterias lácticas Leuconostoc, como: Leuconostoc sp., Leuconostoc mesenteroides subsp. dextranicum, Leuconostoc mesenteroides subsp. mesenteroides, Leuconostoc citreum y Leuconostoc kimchi producen exopolisacáridos (EPS) de dextrano y fructano a partir de la sacarosa, polímeros que consisten en unidades ramificadas y repetitivas de azúcares en proporciones variadas, localizados fuera de la célula, que le brindan al pulque la viscosidad y textura característica (Chacón-Vargas, Torres, Giles-Gómez, Escalante & Gibbons, 2020). Se han realizado diversos trabajos de aislamiento, identificación y potencial probiótico de los microorganismos del pulque y aguamiel a través de la aplicación de diferentes cepas que a continuación se describen: la cepa Leuconostoc mesenteroides subsp. mesenteroides SD23, cuyo efecto probiótico en ratones obesos, mejoró el metabolismo de la glucosa, y redujo: el colesterol sérico y la altura de las vellosidades en el intestino delgado; también el reporte de la evaluación probiótica in vitro e in vivo de la cepa Leuconostoc mesenteroides P45 aislada del pulque de la región de Huitzilac en el estado de Morelos mostró una actividad anti infecciosa contra Salmonella enterica serovar Typhimurium en ratones machos y hembras; la identificación de nuevas cepas probióticas antiinflamatorias, como es el caso, de Lactobacillus sanfranciscensis LBH1068, mejoró la salud de los ratones por pérdida de peso y una disminución significativa de la permeabilidad intestinal; la cepa Lactobacillus casei J57 presentó una posible aplicación probiótica, por la asociación de la actividad de la hidrolasa en las sales biliares (BSH) y con la reducción del colesterol sérico (Castro-Rodríguez, Reyes-Castro, Vega, Rodríguez-González, Yáñez-Fernández & Zambrano, 2020; Giles-Gómez, Sandoval-García, Matus, Campos-Quintana, Bolivar & Escalante, 2016; González-Vázquez, Azaola-Espinosa, Mayorga-Reyes, Reyes-Nava, Shah & Rivera-Espinoza, 2015; Torres-Maravilla et al., 2016). El aislamiento de las cepas de las Bacterias Ácido-Lácticas (BAL) del pulque y del aguamiel provenientes del estado de Hidalgo, 10 de ellas de los géneros Lactobacillus y Pediococcus presentaron un 60% de actividad antimicrobiana contra Escherichia coli y Staphylococcus aureus y el crecimiento de Helicobacter pylori ATCC 43504 junto con la actividad de la ureasa fue suprimido por las BAL (Cervantes-Elizarrarás et al., 2019).
● Tuba
La tuba, es una bebida que se obtiene por la fermentación de la savia colectada de las inflorescencias de las palmas de cocos de la especie Coccos nucifera, principalmente producidas en las regiones costeras de los estados de Colima, Michoacán, Guerrero y Jalisco donde se ha reportado que existen aproximadamente 300,000 cocoteros destinados a la producción de tuba (De La Fuente-Salcido et al., 2015; Ramírez-Guzmán et al., 2019; Uzcanga-Pérez, Camarena-Gómez, Cortazar-Ríos & Góngora-Pérez, 2015). Pertenece al grupo de los “vinos de palma”, obtenidos a partir de las especies de la familia Palmae como la palma aceitera (Elaeis guineensis) (Tatsikou-Fossi, 2015), la palma rafia (Raphia hookeri), la palmera datilera (Phoenix dactylifera), la palma ron (Borassus aethiopum), palma de coyol (Acrocomia aculeata) y palma de cocos (Coccos nucifera), Djeni et al., 2020; Romero-Luna, Hernández-Sánchez & Dávila-Ortiz, 2017. Con respecto al origen de la bebida, a diferencia de la herencia prehispánica del pulque, la tuba proviene del continente asiático, específicamente de Filipinas, como resultado de dos acontecimientos: (a) el primero de ellos ocurrido en el año 1569, cuando el navegante Álvaro de Mendaña introdujo la semilla del coco en la provincia de Colima (b) el segundo momento histórico aconteció a finales del siglo XVI, cuando un número considerable de asiáticos arribó a la provincia de Colima, gracias a la ruta transpacífica que se estableció entre Filipinas y México (Elizondo, 2017; Hernández-López & Iwadare, 2015). El proceso de elaboración de la bebida da inicio a partir de la extracción de la savia de la palma, para obtenerla, se aprovechan las inflorescencias tiernas (con una altura de 45 a 75 cm de largo), que se localizan en la parte superior del cocotero, doblando el eje de estas para que el líquido fluya libremente a partir del corte que se le hace con la precaución de no romper el racimo floral, dejando una especie de filtro del mismo tallo del cocotero, la savia se recolecta por goteo durante la noche (Elizondo, 2017; Martínez-Cervantes, Wong -Paz, Aguilar-Zarate & Muñiz-Márquez, 2019). El proceso se caracteriza por ser lento porque la savia comienza a fluir en tres o cuatro días después de haber realizado el corte y se recolecta dos veces al día. El producto obtenido de una palma en promedio es de 0.65 L por día con una producción anual de 208 L aproximadamente (Flores-Gallegos et al., 2019). Generalmente, la savia recién recolectada es dulce, y de coloración ligeramente parda-transparente, no obstante, debido a la fermentación espontánea propiciada por los microorganismos que posee, cambia a color blanco y ligeramente translúcido, con un pH neutro. Sin embargo, su composición y calidad varían en función del lugar, el momento y la duración de la recolección manteniendo sus características organolépticas en un promedio de dos horas post cosecha. A partir de aproximadamente cinco horas después de la recolección de la savia, se inicia el proceso de fermentación para la producción de la tuba, pero, si la fermentación rebasa un periodo mayor a ocho días a temperatura ambiente se convierte en vinagre para uso doméstico (Flores-Gallegos et al., 2019; Martínez-Cervantes et al., 2019). Se le han atribuido a la tuba beneficios a la salud humana, por sus compuestos bioactivos como minerales, aminoácidos, vitaminas, compuestos polifenólicos, péptidos bioactivos y exopolisacáridos, esta bebida tiene semejanza al pulque en su composición (Elizondo, 2017). Entre sus propiedades biomedicinales los datos son sobre su uso como un agente altamente nutritivo y auxiliar en el tratamiento de las enfermedades gastrointestinales, también hay estudios en que las bebidas fermentadas a partir de la savia de la palma de coco, como es el caso de la tuba, actúan eliminando las especies reactivas del oxígeno (ROS) y previenen el daño del DNA (Astudillo-Melgar, Ochoa-Leyva, Utrilla & Huerta-Beristain, 2019; Chen et al., 2011). En un primer análisis se encontró que los principales géneros bacterianos presentes son las BAL (Fructobacillus, Leuconostoc y Lactococcus), las Bacterias Ácido-Acéticas (BAA) (Gluconacetobacter y Acetobacter) y las Proteobacterias (Vibrio), aunque las especies no han sido identificadas hasta el momento. En cuanto a su actividad probiótica, se ha determinado la presencia de Lactococcus lactis y Enterococcus faecium, bacterias con actividad antimicrobiana por producir bacteriocinas, péptidos de origen ribosomal secretados al medio extracelular y con la capacidad de inhibir el crecimiento de otros microorganismos; otras investigaciones mencionan la presencia de Lactobacillus pentosus, Lactobacillus plantarum y Lactobacillus brevis como potenciales probióticos, en vinos de palma de otras partes del mundo (Astudillo-Melgar et al., 2019; Bertrand et al., 2015; De La Fuente-Salcido et al., 2015; Romero-Luna et al., 2017; Heredia-Castro, Hernández-Mendoza, González-Cordova & Vallejo-Córdoba, 2017).
● Pozol
El Pozol, es una bebida tradicional no alcohólica elaborada con nixtamal fermentado (cocción alcalina de granos de maíz, que genera una masa no pegajosa), preparada por grupos étnicos y mestizos de México (estados de Yucatán, Quintana Roo, Campeche, Tabasco, Chiapas y Oaxaca) y Guatemala (Ampe, ben Omar, Moizar, Wacher & Guyot, 1999; Rizo et al., 2020). El nombre pozol es de origen náhuatl, pozolli, que quiere decir espumoso; pero se le conoce como una bebida de origen Olmeca, debido al registro de que en el estado de Tabasco desde el año 1500 a. C., había bebidas y alimentos elaborados a base de maíz e indicios de que esta cultura usaba las cenizas de la cáscara del ostión para nixtamalizarlo o sea cocido y despellejado, que una vez lavado era usado para elaborar la tortilla, el pozol y el atole. Una parte de ese conocimiento se extendió a la cultura Maya, que ha mantenido el consumo de esta bebida hasta la actualidad (Flores, 2003; Pérez-Flores et al ., 2020). Su preparación consiste en que los granos de maíz se cuecen en una solución de óxido de calcio del 0.5%-2% p/p (peso de soluto/peso de solución), se lavan para eliminar tanto el pericarpio como el exceso de la solución alcalina y finalmente se muelen para hacer bolas de masa que son envueltas en hojas de plátano, se fermentan durante dos a siete días, tras lo cual son suspendidas en agua para consumirse como bebida, agregándole en algunas ocasiones sal y chile; cacao, un bejuco o coco (Marsh et al., 2014; Ramírez-Guzmán et al., 2019; Taboada Ramírez, 2018). Su importancia radica como una bebida ritual y medicinal; los lacandones (una etnia indígena de México) utilizan el pozol mezclado con miel para bajar la fiebre y curar las infecciones gastrointestinales, como cataplasma sobre la piel para sanar heridas y prevenir infecciones cutáneas. Se descubrió también su capacidad antimicrobiana, debido a que puede inhibir una serie de bacterias patógenas, mohos y levaduras (Phister, O´Sullivan & McKay, 2004; Wacher Rodarte, 2004). El pozol, es uno de los primeros alimentos fermentados en los que se analizó la microbiota por métodos independientes del cultivo, los géneros que conforman la microbiota en el proceso de la fermentación son las bacterias lácticas como Lactococcus spp. y Leuconostoc spp., que dominan el inicio de la fermentación y el final de la misma Lactobacillus spp. y Streptococcus spp. Otros géneros, como las bacterias mesófilas aerobias y las pertenecientes al género Enterobacteriaceae también se encuentran presentes durante este proceso ((Phister, O´Sullivan & McKay, 2004; Wacher Rodarte, 2004; Villarreal-Morales et al., 2018). Se han realizado investigaciones, acerca del potencial probiótico de las cepas aisladas del pozol como el análisis de la adhesión a la mucosa intestinal de Streptococcus sp., que como todos los microorganismos probióticos compiten con las bacterias entero patógenas al colonizar el epitelio faríngeo, intestinal y cervical (Chavarin, 2014). La cepa de Bacillus sp. CS93, aislada también del pozol, produce el lipopéptido anti fúngico iturinaA, y los compuestos antibacterianos bacilysina y clorotetaína, además de otros lipopéptidos que corroboran con su acción su propiedad medicinal (Moran, Robertson, Paradisi & Murphy, 2010). También se han analizado cepas de Weisella confusa, que producen exopolisacáridos a partir de la sucrosa, específicamente del dextrano, con actividad sobre los oligosacáridos derivados del xilano -y eventualmente de la celulosa o el almidón-, así como su papel en la síntesis de polisacáridos a través de las glicosil transferasas (GTF); esta habilidad de sintetizar exopolisacáridos con potencial de fibra soluble o prebiótico a través de la actividad de la GTF es una característica adicional (Hernández-Oaxaca et al., 2021). El aislamiento de Leuconostoc citreum CW28, muestra que esta cepa produce inulina de alto peso molecular a partir de la sacarosa y a través de una inulosucrasa multidominio asociada a la célula (IslA). La inulina de alto peso molecular, puede utilizarse directamente como fibra soluble o hidrolizarse para obtener fructooligosacáridos (FOS) y oligofructosa, lo que mostraría una función probiótica (Olvera et al., 2017). Se han realizado pruebas con cepas de bacterias ácido lácticas aisladas del pozol chiapaneco para la elaboración de una bebida a base de lactosuero, adicionada con mermelada de sabor a piña-coco, además de evaluar su potencial probiótico y su aceptación organoléptica, dentro de los hallazgos fue evidente en las pruebas bioquímicas que contenía bacterias benéficas para el consumo humano, por lo que se consideró una bebida probiótica. Sin embargo, el género de las cepas no es proporcionado por el investigador (Velázquez-López, Covatzin-Jirón, Toledo-Meza & Vela-Gutiérrez, 2018).
● Tepache
El tepache es una bebida de consumo en México desde la época prehispánica, su nombre proviene del náhuatl: tepiatl, que significa bebida de maíz, originalmente hecha con este cereal; sin embargo, no se tienen datos exactos de su origen (Taboada Ramírez, 2018). Se consume principalmente en la ciudad de México y se elabora y consume también en los estados de Hidalgo, Puebla, Morelos, San Luis Potosí, Oaxaca, Jalisco y Nayarit, con algunas variantes en el proceso de su preparación con frutas a elegir como: piña (Ananas spp .), manzana (Malus communis) y naranja (Citrus aurantium) (Ramírez-Guzmán et al., 2019). Un ejemplo es con agua, piña, canela, clavo y piloncillo, este último para mejorar su sabor e inducir el proceso de fermentación (Martínez-Cervantes et al., 2019). La fermentación se realiza en barricas de madera llamadas tepacheras, en las que la fruta o frutas maceradas se mezclan con los ingredientes antes mencionados. Las tepacheras se cubren con una tela fina y se fermentan a temperatura ambiente. Al cabo de uno a cuatro días, dependiendo de las condiciones ambientales, se obtiene una bebida refrescante, agradable y dulce, con baja graduación alcohólica (menos del 1%), con un tiempo de fermentación promedio alrededor de 72 horas, si sobrepasa este periodo, la bebida se convierte en vinagre (Corona-González et al., 2013; Moreno-Terrazas, Reyes-Morales, Huerta-Ochoa, Guerrero-Legarreta & Vernon-Carter, 2001; Taboada-Ramírez, 2018). Al tepache se le atribuyen efectos benéficos para la salud, está documentado que cuenta con nutrientes muy eficaces para la supervivencia de los microorganismos probióticos, con actividades como la síntesis y producción de oligosacáridos funcionales, bacteriocinas y exopolisacáridos, la acción principal es en la prevención de enfermedades gastrointestinales, sin embargo, no se cuenta con información extensa acerca de estos beneficios (Martínez-Cervantes et al., 2019). La presencia de las especies de Lactobacillus, como Lactobacillus plantarum, ha sido reportada como probiótico (Romero-Luna et al., 2017). Los microorganismos probióticos presentes en el tepache son: (a) Lactobacillus pentosus ABHEAU-05, esta bacteria ácido láctica mostró resistencia a las pruebas simuladas de digestión gastrointestinal donde se analizó la resistencia a sales biliares, a condiciones ácidas y al ataque enzimático con pepsina (Escobar-Ramírez et al., 2020), (b) Lactococcus lactis TeA1 y Enterococcus faecium TeA2, producen bacteriocinas, que son péptidos, indicadores de que esta bebida contiene una fuente natural de antimicrobianos (De La Fuente-Salcido et al., 2015), (c) Leuconostoc mesenteroides, también produce una bacteriocina llamada mesentericina, y dextranos, que son polisacáridos, de utilidad como prebióticos para otros microorganismos benéficos (Romero-Luna et al., 2017) (d) Enterococcus malodoratus productora de bacteriocina que inhibe a Klebsiella pneumoniae, un patógeno de importancia en la salud pública, causante de infecciones en las vías urinarias y neumonía (Pérez-Villanueva, Vázquez-García, De la Fuente-Salcido & Barboza-Corona, 2016).
Conclusiones
Los ensayos clínicos que abordan las propiedades biomédicas de los probióticos presentes en bebidas fermentadas mexicanas, se han realizado en modelos murinos con los siguientes resultados: disminución del peso corporal y de esteatosis hepática, modulación en el tratamiento de la disbiosis intestinal, prevención de la enfermedad del hígado graso no alcohólico, efectos antiobesidad relacionados con la movilización de grasas y su reducción; disminución de la infección por S. enterica sero- var Typhimurium, efectos protectores tanto en un modelo de colitis inducida como en citoprotectores importantes en la mucosa intestinal que podrían ser extrapolados a humanos. Los experimentos in vitro, en donde se destaca el efecto antimicrobiano de los probióticos, contra patógenos como H. pilory, K. pneumoniae, E. coli y S. Aureus, ayudarían a que su uso reduzca el costo de los tratamientos. La producción de bacteriocinas, brindan una ventaja en la competencia por la sobrevivencia con otros microorganismos, incluyendo a las bacterias resistentes. Las bacteriocinas son péptidos sintetizados en el ribosoma con bioactividad en el medio extracelular, algunos pueden tener efecto bactericida o bacteriostático y su actividad implica el ataque a la permeabilidad y a la despolarización de la membrana citoplasmática provocando la muerte celular. Los beneficios a la salud que se adjudican a las bebidas fermentadas, son el efecto de los microorganismos vivos al momento de su uso o ingesta en el tratamiento de infecciones gastrointestinales y cutáneas, que no son de alto riesgo; en la regulación de la fiebre y como aporte nutricional a la dieta por generar metabolitos, vitaminas y minerales. Es importante mencionar que las bebidas son probióticas, solo cuando por sus características los microorganismos cubren los requisitos. La selección de estas bebidas fue con base en la cantidad de referentes científicos disponibles hoy en día, además de la posibilidad de continuar la experimentación con estos productos. Las cepas potencialmente probióticas que fueron aisladas, identificadas y analizadas son: en el pulque, Leuconostoc mesenteroides subsp. Mesenteroides SD23, Leuconostoc mesenteroides P45, Lactobacillus sanfranciscensis LBH1068, Lactobacillus, Pediococcus y Lactobacillus casei J57; en la tuba, Lactococcus lactis TuAB1 y Enterococcus faecium TuAB2; en el pozol, Streptococcus sp., Bacillus sp. CS93, Weisella confusa y Leuconostoc citreum CW28; en el tepache, Lactobacillus pentosus ABHEAU-05, Lactococcus lactis TeA1, Enterococcus faecium TeA2, Leuconostoc mesenteroides y Enterococcus malodoratus. En México existe una gran variedad de bebidas tradicionales fermentadas, sin embargo, no hay evidencia suficiente que permita sustentar la existencia de probióticos en ellas y sus posibles aplicaciones, algunos ejemplos de bebidas que merecería la atención de ser analizado su contenido son el tejuino, la taberna, el axokot o el pulque de tuna.











 nueva página del texto (beta)
nueva página del texto (beta)


