Introducción
Los procedimientos endoscópicos se utilizan en todo el mundo para el examen, diagnóstico y tratamiento de algunas enfermedades1. Las principales causas de infecciones nosocomiales están relacionadas con estudios invasivos, entre los que se encuentran los procedimientos endoscópicos2; ya que emplean dispositivos que tienen tubos largos y difíciles de limpiar, y debido a que las fibras ópticas encerradas, necesarias para la visualización, son sensibles al calor, no se pueden esterilizar en autoclave. Durante los estudios, estos dispositivos médicos pueden contaminarse con sangre, fluidos corporales y secreciones, que pueden contener no solo materia orgánica, sino también microorganismos potencialmente patógenos3,4. Debido al complejo diseño de los endoscopios con múltiples canales estrechos, son instrumentos difíciles de limpiar y desinfectar5,6. Otro aspecto importante que contribuye a la falla de la desinfección es la capacidad de algunas bacterias para formar biopelículas en las partes difíciles de alcanzar del endoscopio, principalmente cuando existe algún daño físico en el dispositivo7.
Las biopelículas se desarrollan rápidamente; son estructuras bien organizadas altamente resistentes a los efectos de antibióticos y desinfectantes8-10. Lo anterior muestra la importancia de adoptar métodos de muestreo efectivos después del reprocesamiento de endoscopios, que permitan identificar microorganismos que se encuentran fuertemente adheridos a las paredes internas de estos dispositivos11.
El reprocesamiento de endoscopios es extremadamente importante y debido a su fracaso se han reportado tasas de infección postendoscópica de 1.1 para colonoscopia; 3.0 para esofagogastroduodenoscopia; 15.6 para broncoscopia y 4.4 para cistoscopia por cada 1,000 procedimientos endoscópicos12. Un estudio en Taiwán evaluó la incidencia de infección 30 días después de la colonoscopia y la sigmoidoscopia y los resultados revelaron que en 112,543 pacientes que fueron sometidos a procedimientos endoscópicos la incidencia global de infección fue del 0.37%, siendo la diverticulitis, peritonitis y apendicitis las infecciones más frecuentes13. Esto demuestra que las infecciones postendoscópicas son más comunes de lo que se pensaba y pueden variar considerablemente, ya que las verdaderas tasas de transmisión durante los procesos endoscópicos pueden pasar desapercibidas debido a una vigilancia postendoscópica inadecuada o inexistente desde el punto de vista microbiológico. Las infecciones relacionadas con los procedimientos endoscópicos se pueden dividir en endógenas y exógenas. Las infecciones endógenas son aquellas causadas por la flora microbiana del propio paciente, principalmente Escherichia coli, Klebsiella spp., Enterobacter spp. y Enterococcus spp. Las infecciones exógenas se refieren a aquellas que se transmiten al paciente por o desde el endoscopio o cualquiera de los accesorios utilizados en el procedimiento; Pseudomonas aeruginosa, Salmonella spp. y Mycobacterium spp. son las más frecuentes14,15.
Este último tipo de infecciones se pueden prevenir mediante estrictos métodos de control de calidad microbiológica, ya que estas infecciones se relacionan principalmente con el uso de equipos dañados, procesos inadecuados de limpieza, desinfección y secado, así como el incumplimiento con los protocolos recomendados. Se ha recomendado que estos procesos solo deben ser realizados por personal especializado y capacitado, ya que un procesamiento adecuado logrará la eliminación de microorganismos con un margen de seguridad aceptable5,16. Como se mencionó anteriormente, entre las principales acciones en el control de infecciones en endoscopia se encuentra el cultivo microbiológico de los canales del endoscopio después del reprocesamiento para la búsqueda de bacterias contaminantes y principalmente la adopción de métodos estándar de control de infecciones y descontaminación. Trabajos previos han observado que el tipo de muestreo en los canales del endoscopio impacta directamente en la recuperación de bacterias11. Sin embargo no se reportan hallazgos bacteriológicos y fenotipos de resistencia antimicrobiana que destaquen el riesgo potencial de estos patógenos como agentes causantes de infecciones exógenas. El objetivo de este trabajo es comparar la tasa de contaminación bacteriana de los canales de endoscopios reprocesados mediante cultivo del agua de irrigación y la obtenida posterior a un cepillado de los canales. Un objetivo secundario fue determinar la sensibilidad antimicrobiana de los patógenos aislados en ambos métodos.
Material y métodos
Consideraciones éticas
El Comité Institucional de Investigación, Ética y Bioseguridad del Hospital Juárez de México (HJM) aprobó el protocolo (número de registro HJM 0432/18-I) de conformidad con el Reglamento de la Ley General de Salud en Materia de Investigación para la Salud (http://www.conbioetica-mexico.salud.gob.mx/descargas/pdf/normatividad/normatinacional/10._NAL._Reglamento_de_Investigacion.pdf)13.
Endoscopios analizados
Durante julio de 2020 se realizó un análisis observacional prospectivo y microbiológico de 26 endoscopios flexibles (duodenoscopios, gastroscopios, colonoscopios, broncoscopios y ecoendoscopios) utilizados en tracto digestivo, vías biliares y vías aéreas inferiores utilizados en pacientes del Servicio de Endoscopia del HJM. En la tabla 1 se muestra el tipo y número de los endoscopios analizados en este estudio.
Tabla 1 Tasa porcentual de contaminación (por canal) de los endoscopios reprocesados utilizados en pacientes del Servicio de Endoscopia del Hospital Juárez de México, y distribución de la contaminación bacteriana con los métodos A y B (con y sin cepillado de canales)
| Endoscopio analizado | n (%) | Cultivo bacteriano (tasa de contaminación) | Microorganismos identificados | |||||
|---|---|---|---|---|---|---|---|---|
| Negativo Método A*/‡ | Positivo Método B†/‡ | Canales positivos n (%) | Canales | |||||
| Canales n (%) | Succión | Trabajo | ||||||
| Succión | Trabajo | Succión | Trabajo | |||||
| Duodenoscopio | 3 | 3 (100) | 3 (100) | 1 (33.3) | 2 (66.6) | 3 (50.0) | A, B, C | A, B, C, E |
| Gastroscopio | 10 | 10 (100) | 10 (100) | 4 (40.0) | 4 (40.0) | 8 (40.0) | D, F, G | B, D, E, F, G |
| Colonoscopio | 5 | 5 (100) | 5 (100) | 1 (20.0) | 1 (20.0) | 2 (20.0) | B | B, F, G |
| Broncoscopio | 3 | 3 (100) | 3 (100) | 0 (0) | 1 (33.3) | 1 (16.6) | - | B, G |
| Ecoendoscopio | 5 | 5 (100) | 5 (100) | 1 (20.0) | 1 (20.0) | 2 (20.0) | E | B, F, H |
| 26 | 26 (100) | 26 (100) | 7 (26.9)‡ | 8 (30.7)‡ | 16 (30.7) | |||
*Muestreo por irrigación sin cepillado de canales.
†Muestreo por irrigación con cepillado de canales.
‡Diferencia estadísticamente significativa (nivel de significación α = 0.05) A: Staphylococcus aureus; B: Escherichia coli; C: Citrobacter freundii; D: Micrococcus luteus; E: Pseudomonas aeruginosa; F: Bacillus subtilis; G: Bacillus megaterium; H: Proteus mirabilis.
Reprocesamiento de endoscopios
LIMPIEZA PREVIA O PREPARACIÓN PARA LA LIMPIEZA
Los endoscopios se sometieron a una limpieza externa eliminando la materia orgánica visible. Esto se hizo con una gasa empapada en detergente enzim zime®AW Plus Premium diluido (Ruhof, Mineola, NY) según las recomendaciones del fabricante (3 ml por litro de agua). Finalmente, se aspiraron 500 ml de detergente enzimático diluido por los canales de aspiración y trabajo de cada uno de los endoscopios, con el objetivo de eliminar por arrastre e irrigación la mayor parte de los restos de materia orgánica y fluidos corporales atrapados en los canales.
LIMPIEZA MANUAL DE LOS ENDOSCOPIOS
Para descartar pérdida de integridad de la cubierta plástica de los endoscopios, estos fueron trasladados al área de lavado manual, donde se realizaron pruebas de hermeticidad o de fugas utilizando MU-1 (OlympusTM, Japón, Tokio) y SHA-P5 (PentaxTM, Hamburgo) detectores de fugas según las especificaciones del fabricante. Luego de verificar la hermeticidad de los dispositivos, se desconectó el probador de fugas y se agregó inmediatamente el detergente enzimático Endozime® AW Plus Premium para realizar lavado manual con fricción de gasa en la superficie externa del endoscopio e internamente con cepillo de limpieza endoscópico OlympusTM y PentaxTM por eliminación de materia orgánica adherida. Después del cepillado, los canales se irrigaron con el sistema de riego OlympusTM y PentaxTM para eliminar la materia orgánica eliminada. Para canales de aire y agua (excepto broncoscopios) solo se realizó irrigación con detergente enzimático. Finalmente, los canales y las superficies externas se enjuagaron con agua estéril.
REPROCESAMIENTO AUTOMATIZADO DE ENDOSCOPIOS
El reprocesamiento se llevó a cabo usando la máquina automática de reprocesamiento de doble lavado Medivator DSD EDGETM AER (EE.UU., Indianápolis). Para ello se utilizó el ciclo de riego con agua sometida a ultrafiltración a través de filtros de 2, 1 y 0.45 μm (micrómetro). Al final del ciclo, se inició un ciclo de riego por aire para eliminar el exceso de agua. Finalmente, se realizó un ciclo de riego de desinfectante de alto nivel (orto-ftalaldehído 0.575% RapicideTM OPA/28, EE.UU., Indianápolis) durante 5 minutos a 24 °C seguido de un ciclo de enjuague con agua ultrafiltrada. Para finalizar el reprocesado se realizó un segundo proceso de desinfección mediante un ciclo de riego con alcohol al 70% seguido de riego con aire. Todos los endoscopios reprocesados se sometieron a análisis microbiológicos como se explica a continuación.
Muestreo bacteriano de canales de endoscopios
Para el cultivo microbiológico de los endoscopios que pasaron por reprocesamiento (manual y automatizado) se siguieron dos estrategias de muestreo microbiológico:
− Muestreo microbiológico sin cepillado de canales (método A). Los canales de trabajo y aspiración de los endoscopios fueron analizados microbiológicamente mediante irrigación a presión de 20 ml de agua estéril utilizando jeringas del mismo volumen. El agua resultante del riego se recolectó en tubos de 50 ml y se almacenó a 4 oC antes del análisis microbiológico. Las muestras de agua de cada canal se recolectaron por separado.
− Muestreo microbiológico con cepillado de canales (método B). Los mismos endoscopios que se sometieron al método A se sometieron a un segundo análisis microbiológico como sigue. Se realizó una irrigación a presión controlada con 20 ml de agua estéril, asegurando que el agua quedara atrapada en los canales de trabajo y aspiración. Inmediatamente, los canales fueron cepillados utilizando cepillos endoscópicos desechables CS6021t (PentaxTM). El agua resultante del riego tras el cepillado se recogió en un tubo estéril de 50 ml y se almacenó a 4 oC antes del análisis microbiológico. Las muestras de agua de cada canal se recolectaron por separado.
Aislamiento e identificación de bacterias de canales de endoscopios
Las muestras recolectadas se sometieron a un enriquecimiento no selectivo en caldo de infusión de cerebro y corazón durante 24-72 horas a 37 oC. Aquellas muestras que mostraron un crecimiento bacteriano visible se sometieron a aislamiento selectivo de la siguiente manera. Las muestras se sembraron en agares enriquecidos y selectivos (agar sangre, MacConkey, sal y manitol) (Becton Dickinson & Co., Franklin Lakes, NJ, EE.UU.). Las placas se incubaron aeróbicamente a 37 °C durante 24-48 horas. Posteriormente, las cepas microbianas típicas se purificaron en agar LB. La identificación de las cepas se realizó utilizando BD PhoenixTM (Brea, California, EE.UU.) de acuerdo con el protocolo del fabricante.
Ensayos de susceptibilidad/resistencia
La resistencia/susceptibilidad a los antimicrobianos se realizó utilizando el método de difusión en disco de acuerdo con las pautas establecidas por The Clinical and Laboratory Standards Institute (CLSI, 2019). Se utilizaron 12 agentes antimicrobianos para bacterias grampositivas y 12 para bacterias gramnegativas (Multibac-ID, México, CDMX). P. aeruginosa ATCC 27853 y Staphylococcus aureus ATCC 43300 se usaron como controles. Los resultados se infirieron como resistentes por ausencia de zona de inhibición.
Análisis estadístico
Se utilizó una prueba de chi cuadrada para determinar la asociación entre la contaminación bacteriana y los métodos de desinfección (A y B) y el tipo de canales (de trabajo y de succión) en los endoscopios incluidos en este estudio. La estadística se realizó utilizando el software SAS a un nivel de significación de α = 0.05.
Resultados
Influencia del método de muestreo de canales en los resultados del cultivo microbiológico
Un total de 26 endoscopios fueron sometidos a análisis microbiológicos luego del proceso de reprocesamiento, que incluyó limpieza y desinfección de alto nivel. La primera estrategia de análisis microbiológico (método A) reveló una tasa de contaminación bacteriana residual cero en los canales de succión y de trabajo. Bajo estos antecedentes, estos mismos endoscopios fueron sometidos a un segundo procedimiento de muestreo microbiológico (método B). Los resultados microbiológicos obtenidos por este último método mostraron índices de contaminación del 30.7%, correspondientes a 16 endoscopios contaminados. Del total de endoscopios analizados (n = 26), este número de endoscopios con bacterias residuales correspondió a una frecuencia de 61.53%. Los índices de contaminación más altos se identificaron en los gastroscopios y duodenoscopios, sin embargo no se identificó una diferencia significativa en los índices de contaminación entre los canales de succión y de trabajo de estos mismos endoscopios. La tabla 1 resume los hallazgos en las incidencias de contaminación microbiana después del muestreo microbiológico usando el método B.
Aislamiento e identificación de bacterias en endoscopios
Las 25 cepas bacterianas aisladas de los endoscopios con el método B pertenecen a siete grupos bacterianos, formados por S. aureus (n = 2), E. coli (n = 7), Citrobacter freundii (n = 2), Micrococcus luteus (n = 2), P. aeruginosa (n = 3), Bacillus subtilis (n = 4), Bacillus megaterium (n = 4) y Proteus mirabilis (n = 1). Como se muestra en la figura 1, las familias más frecuentes de organismos aislados pertenecen a Enterobacteriaceae, Bacillaceae, Pseudomonadaceae, Micrococcaceae y Staphylococcaceae. Los hallazgos microbiológicos mostraron que el número de aislamientos fue mayor en el canal de trabajo (n = 17) en comparación con el canal de succión (n = 8) (Fig. 1A).
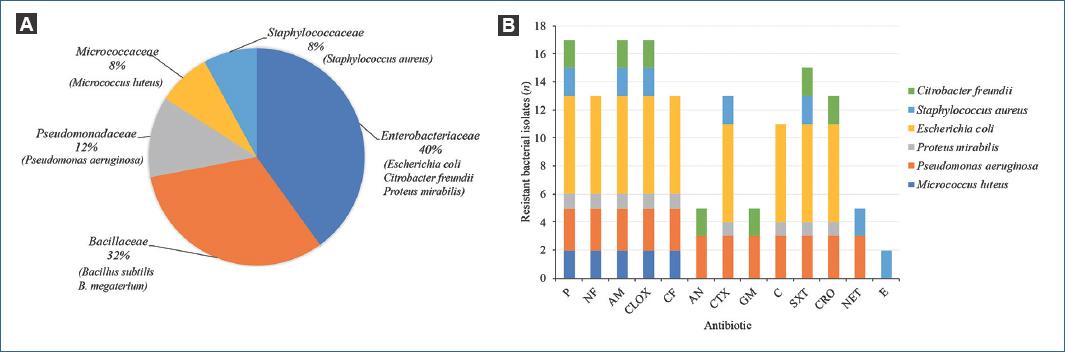
Figura 1 A: frecuencia de cepas de contaminación bacteriana aisladas de endoscopios reprocesados utilizados en pacientes del Servicio de Endoscopia del Hospital Juárez de México. B: resistencia antimicrobiana de cepas de contaminación bacteriana aisladas de endoscopios reprocesados. Las abreviaturas de los antibióticos se describen en la sección Materiales y métodos.
Ensayos de susceptibilidad/resistencia
Las cepas aisladas de endoscopios se sometieron a ensayos de resistencia antimicrobiana utilizando 12 antibióticos agrupados en ocho familias diferentes (betalactámicos, nitrofuranos, cefalosporinas, aminoglucósidos, fenicoles, sulfonamidas, diaminopirimidinas y macrólidos). En general, la resistencia a los antibióticos de la familia de los betalactámicos (100%) fue la más alta, seguida de las sulfonamidas y diaminopirimidinas (88.2%), cefalosporinas y nitrofuranos (76.4%), fenicoles (64.7%), aminoglucósidos (29.4%) y, finalmente, macrólidos (11.7%). La figura 1B muestra los aislamientos (por género y especie) que mostraron resistencia a los antibióticos probados. El mayor número de aislamientos resistentes a la mayoría de los antibióticos probados fue E. coli. Sin embargo, aunque el número de aislamientos de P. aeruginosa (n = 3) fue menor en comparación con E. coli, presentó un fenotipo de mayor resistencia. Por lo tanto, los resultados revelaron que las cepas de P. aeruginosa se clasificaron como resistentes a múltiples fármacos (MDR). Por el contrario, el resto de aislados gramnegativos (P. mirabilis y C. freundii) presentaron un fenotipo de menor resistencia a los antibióticos ensayados. Finalmente, los aislados grampositivos (S. aureus y M. luteus) mostraron resistencia a siete y cinco antibióticos probados, respectivamente (Fig. 1B).
Discusión
Una parte fundamental de las estrategias de prevención y control de infecciones es la adecuada limpieza y desinfección de los dispositivos y equipos biomédicos. Muchos de ellos, a pesar de ser considerados semicríticos, cuentan con adaptaciones para procedimientos críticos, lo que genera un mayor riesgo de infecciones asociadas a la atención de la salud por microorganismos resistentes a los antibióticos y formadores de biopelículas10,17,18. Los endoscopios, al ser dispositivos médicos utilizados en procesos invasivos y mecánicamente complejos, ya que contienen conductos de diámetro milimétrico, tienen altas probabilidades de que las bacterias formadoras de biopelículas puedan asentarse y ser difíciles de eliminar durante su reprocesamiento15,19.
Existe suficiente investigación sobre brotes de bacterias multirresistentes asociadas a procesos endoscópicos, por lo que en el presente trabajo demostramos el impacto del cepillado de los canales de trabajo y succión de los endoscopios utilizados en pacientes del HJM sobre los resultados microbiológicos, y que podría ser una fuente importante de patógenos causantes de brotes hospitalarios20,21.
Los hallazgos de este trabajo mostraron la recuperación de patógenos clínicamente importantes que ya han sido reportados como agentes causantes de infecciones exógenas después de procedimientos endoscópicos. Siendo la familia Enterobacteriaceae microorganismos que forman parte de la biota gastrointestinal de los animales de sangre caliente, se evidencia que fue el grupo más identificado (40%). Wendorf et al. (2015) reportaron un brote de E. coli portadora de una betalactamasa tipo AmpC asociada a procedimientos endoscópicos por colangiopancreatografía22. El análisis epidemiológico reveló mortalidades del 16%, lo que demuestra la importancia en la adopción de controles microbiológicos exhaustivos después del reprocesamiento del endoscopio. La identificación de E. coli en este trabajo con resistencia a nueve de 12 antibióticos probados sugiere posibles implicaciones médicas en pacientes sometidos a procedimientos endoscópicos contaminados con este patógeno con posibles fallas en el tratamiento antimicrobiano. Otras enterobacterias identificadas en este trabajo (C. freundii y P. mirabilis) también han sido reportadas previamente como agentes causantes de infecciones exógenas asociadas a procesos endoscópicos23,24.
En relación con las segundas bacterias más abundantes, bacterias del género Bacillus spp., han sido reconocidas como agentes contaminantes de origen ambiental. Sin embargo, estudios recientes reconocen a este género bacteriano como un potencial patógeno nosocomial resistente a los antibióticos25. La identificación de bacterias de este género en los endoscopios analizados muestra la resiliencia de estas bacterias formando biopelículas y que poseen estructuras de resistencia, como las esporas. Miner et al. (2007) demostraron la presencia de bacterias del género Bacillus spp. en endoscopios, especulando que los endoscopios podrían estar contaminados con biopelículas debido a deficiencias en la limpieza, desinfección, enjuague, secado y almacenamiento durante el reprocesamiento de los endoscopios26. P. aeruginosa ha sido uno de los principales patógenos formadores de biopelículas causantes de infecciones exógenas asociadas a procedimientos endoscópicos19,27. La presencia de este patógeno, aunque en baja frecuencia, en duodenoscopios y gastroscopios, según el fenotipo de resistencia antimicrobiana se categorizó como MDR. Trabajos futuros estarán dirigidos a la búsqueda de genotipos asociados con la resistencia a múltiples fármacos en estos aislados. Los grupos bacterianos menos abundantes estuvieron constituidos por bacterias del género Micrococcus spp. y Staphylococcus spp., identificados en duodenoscopios y gastroscopios. Rauwers et al. (2018) informaron la presencia de estos dos géneros bacterianos, que son bacterias fuertemente formadoras de biopelículas que suelen ser difíciles de eliminar, en endoscopios reprocesados28. Aunque ahora existe la aprobación de la Food and Drug Administration (FDA) del primer duodenoscopio de un solo uso, y se ha demostrado su eficacia, con altas calificaciones de rendimiento del dispositivo, existen desventajas, ya que el equipo es de difícil acceso para los hospitales en los países en desarrollo debido a su alto costo29,30. Para tener seguridad en el uso de endoscopios reutilizables es necesario que los dispositivos sean reprocesados de manera adecuada, previo a cada procedimiento, a fin de eliminar cualquier riesgo de transmisión de infección de un paciente a otro, y por supuesto a cultivos microbiológicos que validen el reprocesamiento de los dispositivos. Dado que no existen lineamientos en los manuales operativos sobre el uso y reprocesamiento de endoscopios, la inclusión de controles microbiológicos podría ser una excelente alternativa para asegurar el protocolo de reprocesamiento. Ya se han informado las consecuencias críticas del reprocesamiento deficiente de endoscopios. Carbonne et al. (2010) describieron un brote de Klebsiella pneumoniae productora de carbapenemasas (KPC) tipo 2 en tres hospitales de Francia31. En total identificaron 13 casos, dos infecciones y nueve colonizaciones, incluido un caso trasladado desde un hospital griego. De los 13 casos, siete fueron secundarios al uso de un duodenoscopio contaminado y cinco casos se asociaron con transmisión directa de paciente a paciente dentro del hospital. Todas las cepas detectadas en los casos mostraron multirresistencia. En 2014 se notificó un brote de nueve pacientes con cultivos positivos para E. coli productora de una metalo-betalactamasa blaNDM, ocho de estos pacientes fueron tratados en el mismo hospital. Después de la limpieza manual y la desinfección de alto nivel en el reprocesador automático de endoscopios, se obtuvieron cultivos de los endoscopios utilizados en los cinco pacientes, se recuperaron aislados de E. coli blaNDM y K. pneumoniae KPC del dispositivo32. Por el contrario, Kovaleva et al. (2010) informaron que los endoscopios pueden limpiarse y desinfectarse, pero no esterilizarse después de su uso, el control del proceso de limpieza y desinfección no garantiza la prevención de la formación de biopelículas durante los procedimientos endoscópicos19. Las directrices de la Sociedad Australiana de Gastroenterología exigen el cepillado y el enjuague para toda la vigilancia del endoscopio desde al menos 2010, donde se indica que se requiere que los endoscopios se prueben cada uno a tres meses y durante la capacitación del personal si se introducen nuevos equipos. La British Gastroenterological Society también sugiere cepillado + lavado para la vigilancia con endoscopio. Las pautas de la Sociedad Mundial de Gastroenterología de 2019 recomiendan utilizar las pautas de la FDA para los métodos de muestreo de vigilancia de duodenoscopios que incluyen un lavado/cepillado/lavado que también ha sido validado por los fabricantes de duodenoscopios, técnica empleada en este estudio. En México no se tiene información publicada de las pautas utilizadas en los diferentes centros hospitalarios tanto públicos como privados para muestreo de vigilancia de endoscopios flexibles. En el estudio de Robles et al.33, donde realizaron una evaluación microbiológica de la desinfección de alto nivel de endoscopios flexibles, mediante la obtención de muestras de tres áreas del endoscopio (superficie, canal de biopsia y canal de aire/agua) y se recogió una muestra del agua de enjuague final. Adicionalmente, se tomaba una muestra al inicio de la semana de la botella de agua. Las muestras se colocaron en medios de cultivo para ser transportadas y se cultivaron en dos medios: agar sangre y MacConkey; técnica muy similar a la empleada en nuestro estudio. En este estudio el 6.7% de los endoscopios tuvieron un cultivo positivo, aislando diversas especies de Pseudomonas, al igual a lo observado en nuestro estudio.
Conclusiones
Es necesaria la implementación de capacitación continua del personal en términos de limpieza y reprocesamiento de endoscopios, la vigilancia microbiológica del reprocesamiento de endoscopios con muestreo mejorado para detectar la colonización temprana del dispositivo por bacterias resistentes y la formación de biopelículas para prevenir la contaminación y, por lo tanto, la generación de infecciones asociadas a la atención de salud (IAAS) derivadas de procedimientos endoscópicos. También es preciso estandarizar procesos en los diversos centros hospitalarios en nuestro país para garantizar el adecuado reprocesamiento de los endoscopios.











 nueva página del texto (beta)
nueva página del texto (beta)


