La diarrea epidémica porcina es una enfermedad entérica altamente contagiosa en los cerdos causada por el virus de la Diarrea Epidémica Porcina (PED)1, es un virus de ARN monocatenario de sentido positivo y envuelto que pertenece al género Alphacoronavirus, familia Coronaviridae2. Infecta principalmente las células epiteliales del intestino de los cerdos, produciendo atrofia, necrosis y desprendimiento de las vellosidades intestinales, lo que afecta la absorción de nutrientes3, ocasionando problemas como diarrea acuosa, vómitos agudos, anorexia, deshidratación extensa, electrolitos sanguíneos desequilibrados y pérdida de peso en cerdos de todas las edades4. Es especialmente grave en los lechones seronegativos, entre los que la tasa de morbilidad y mortalidad es de hasta el 100 %5. El virus se identificó en la década de 1970 en Reino Unido y Bélgica. En 1976 se produjo una epidemia similar en varios países europeos, y se denominó EVDII; desde entonces, la enfermedad ha sido reportada en muchos otros países6,7. En octubre de 2010, se identificó una variante altamente patógena de la cepa del virus de PED en China, y más tarde en mayo de 2013, esta misma variante causó enfermedad en EE.UU., que se extendió a Canadá y otros países de centro y Sudamérica, entre ellos, México6,8, se estimó que en los EE. UU., el brote de PED afectó a más de 8,400 granjas9, matando a más de 7 millones de cerdos equivalente al 10 % de su población porcina10, con pérdidas de $1.1 mil millones de dólares para los productores11.
Las medidas conocidas para el control había sido el “feedback” o “licuado”, sin embargo, no existe una homogeneidad en el uso de esta técnica12,13. Consiste en la ingesta de intestino delgado, contenido gástrico o diarrea de los cerdos que presentan signos clínicos de la PED en las primeras 6 a 12 h. Así mismo puede prepararse con el raspado intestinal de lechones sacrificados que presetan diarreas en las últimas 4 h y se pueden mezclar con leche evaporada, tratando de lograr una consistencia líquida y no pastosa Su uso puede ocasionar la transmisión de otras enfermedades presentes en la piara14. Existe otro tipo de profilaxis como la inmunización oral con el virus de la DEP obtenido a partir del aislamiento en cultivo celular, lo que permite cuantificar el virus infectivo y calcular una dosis protectora, así como asegurar que solo se está utilizando como inóculo al virus y no otros agentes15,16. La mayoría de las vacunas que se comercializan en México son vacunas vivas atenuadas o inactivadas que utilizan cepas similares a CV777 y que se administran por la vía oral15, en las que se recomienda el uso en hembras gestantes en la 2da y 3ra semana antes del parto16. Se ha observado estrés con el uso de la vacuna en las cerdas gestantes17, y su efectividad continúa en evaluación.
El objetivo del presente estudio fue comparar el tiempo de seroconversión, en cerdas inoculadas con virus cuantificado, con cuatro diferentes vehículos (leche, trigo, directo y agua) y diferentes dosis del vehículo (1 ml, 2 ml y 3 ml), en diferentes momentos de gestación y paridad de las cerdas.
El estudio se realizó en una granja semi-tecnificada de ciclo completo que se localiza en el noreste del Estado de México, tiene 170 hembras promedio en el inventario, cruza de Landrace x Yorkshire.
El método para la manipulación de los animales fue sometido y aprobado por el Subcomité Institucional para el Cuidado y Uso de los Animales de Experimentación (SICUAE), de la Facultad de Medicina Veterinaria y Zootécnica FMVZ CU-UNAM, con número de aprobación MC-2020/4-4.
El virus se obtuvo del Laboratorio de Virología de la Facultad de Medicina Veterinaria y Zootecnia, de la Universidad Nacional Autónoma de México, identificado en el Gen Bank con el número de acceso KM044335.1, que tiene un título de 1x108 DICC50%/ml18,19.
Las cerdas se inmunizaron con 12 diferentes protocolos de intervención contra el PED el 26 de enero del 2018. Las variantes de este protocolo fueron administrar el virus cuantificado en cuatro diferentes vehículos los cuales fueron: leche, trigo, agua y sin vehículo-directo (suspensión viral en medio de cultivo), con tres diferentes dosis de cada vehículo, 1 ml, 2 ml y 3 ml (Cuadro 1). El protocolo de inoculación se realizó en todas las cerdas de la granja en forma de sabana.
Cuadro 1 Resumen del diseño experimental
| Grupo | Vehículo | Dosis | Concentración del virus (DICC50%/ml) |
No. de animales |
|---|---|---|---|---|
| 1 | Leche | 1 ml | 1x108 | 8 |
| 2 | Leche | 2 ml | 2x108 | 6 |
| 3 | Leche | 3 ml | 3x108 | 10 |
| 4 | Trigo | 1 ml | 1x108 | 8 |
| 5 | Trigo | 2 ml | 2x108 | 8 |
| 6 | Trigo | 3 ml | 3x108 | 10 |
| 7 | Agua | 1 ml | 1x108 | 8 |
| 8 | Agua | 2 ml | 2x108 | 8 |
| 9 | Agua | 3 ml | 3x108 | 10 |
| 10 | Directo | 1 ml | 1x108 | 7 |
| 11 | Directo | 2 ml | 2x108 | 8 |
| 12 | Directo | 3 ml | 3x108 | 9 |
Posterior a la administración de los diferentes protocolos de intervención, en la semana 2, 4, 8 y 13 se tomaron muestras sanguíneas a las cerdas, en tubos para recolección de muestras sanguíneas sin aditivo. Estas muestras se transfirieron en cajas de hielo entre 2 a 8 °C al Laboratorio de Virología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México. Las muestras se procesaron mediante la técnica de ELISA del Kit ID Screen® PEDV indirect (ID-VET), con las especificaciones del proveedor, ID Screen® PEDV Indirecto - IDVet18. La prueba de ELISA se utilizó con el fin de monitorear los diferentes protocolos de inmunización de las hembras y poder identificar a las hembras que mostraron seroconversión.
Los datos de seroconversión se analizaron con estadística descriptiva y con la curva de supervivencia de Kaplan-Meier y la prueba de rango logarítmico de Mantel-Cox, respectivamente, Se consideró estadísticamente significativo un valor de P<0.05. Los protocolos de intervención se muestran en el Cuadro 2.
Cuadro 2 Grupos como se compararon los diferentes vehículos y dosis, en la prueba de la curva de supervivencia de Kaplan-Maier y la prueba de rango logarítmico de Mantel-Cox
| Grupos | Comparación |
|---|---|
| 1 | Leche 1 ml, leche 2 ml y leche 3 ml |
| 2 | Trigo 1 ml, trigo 2 ml y trigo 3 ml |
| 3 | Directo 1 ml, directo 2 ml y directo 3 ml |
| 4 | Agua 1 ml, agua 2 ml y agua 3 ml |
| 5 | Leche 1 ml, trigo 1 ml, directo 1 ml y agua 1 ml |
| 6 | Leche 2 ml, trigo 2 ml, directo 2 ml y agua 2 ml |
| 7 | Leche 3 ml, trigo 3 ml, directo 3 ml y agua 3 ml |
Cada ml de los vehículos contiene 1x108 DICC50%/ml del virus PED.
Se observó que dos vehículos fueron los que presentaron mejor respuesta de seroconversión con la dosis de 1 ml (vehículo directo y el vehículo con agua), mientras que el vehículo que tuvo la seroconversión más baja fue el trigo (Figura 1).
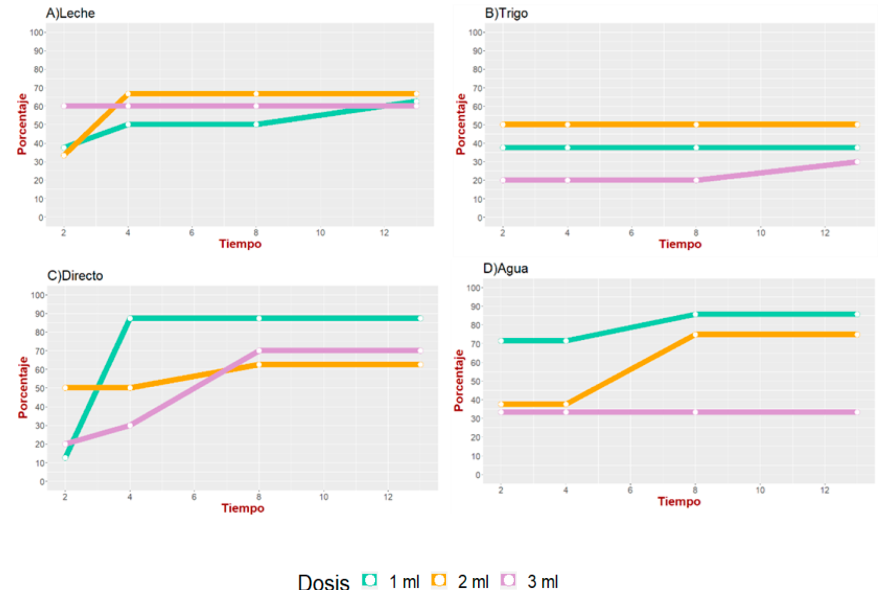
Figura 1 Porcentaje de seroconversión de los cuatro diferentes vehículos del inóculo (agua, directo, leche y trigo) con tres diferentes dosis, en cuatro diferentes tiempos posterior a la administración del inóculo
Solo se encontró diferencia en los grupos 2 y 7, en cuanto al tiempo de supervivencia, Mantel-Cox, χ2 = 12.56, 2 gl; P= 0.0019 y χ2 = 15.75, 3 gl; P= 0.0013 (Figura 2), respectivamente,
Los vehículos agua y leche mostraron una seroconversión mayor a 45 % y del 60 %, en la semana 2 y 6, respectivamente.
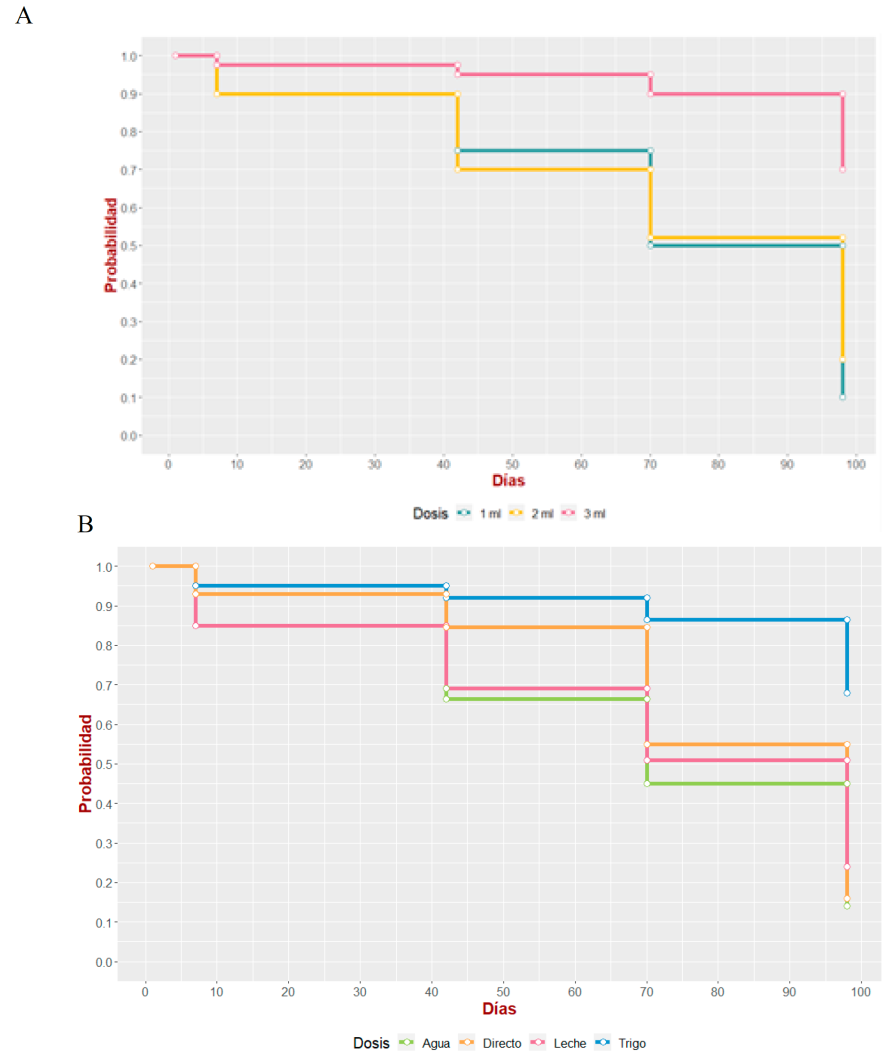
Figura 2 Curva de supervivencia de Kaplan-Meier, A) curva de cerdos domésticos inoculados con el vehículo de trigo, días posteriores a la inoculación. B) cerdos domésticos inoculados con 4 diferentes vehículos con dosis de 3 ml, días posteriores a la inoculación
El uso de diferentes vehículos y dosis han sido usadas y descritos por diferentes autores12,13,20, aunque no se ha comprobado la efectividad de uno sobre otro. En este trabajo el inóculo agua y directo con 1 ml fueron los mejores. Sin embargo, no hubo diferencia entre los diferentes vehículos y dosis, con excepción del inóculo con trigo y las dosis de tres mililitros con los diferentes vehículos (Figura 2)
En ensayos serológicos, en promedio, los anticuerpos se detectan por primera vez en el suero entre los 6 y 14 días después del contacto con el virus21. En el presente trabajo se encontró que a partir de la segunda semana un pequeño porcentaje de cerdas ya presentaron anticuerpos de PED, mientras que durante la semana 10 y 14 la mayoría de las cerdas expuestas al virus de PED presentaron anticuerpos. También se encontró que el efecto de seroconversión difirió según el vehículo o dosis con la que se exponían al virus de PED a las cerdas.
Los niveles de anticuerpos en cerdas naturalmente infectadas por el virus de PED permanecen altos hasta por seis meses, aunque los niveles recuperados de heces desaparecen entre uno y dos meses postinfección22.
Se ha reportado que la inmunización de las cerdas gestantes es importante para el control del PED y para reducir la muerte de lechones23,24. Existen reportes en donde el 100 % de los lechones provenientes de cerdas inmunizadas entre los 57 a 59 días de gestación sobreviven24, mientras que aquellas expuestas entre los 19 y 22 así como las expuestas después de los 96 días de gestación, mostraron tasas de supervivencia de lechones de 87 y 56 %, respectivamente25.
La eficacia de la vacuna y del refuerzo por vía intramuscular, depende de la inducción de células B de memoria de anticuerpos IgA en cerdas expuestas previamente al virus de campo o inmunizadas oralmente26. En este trabajo se utilizaron protocolos de inmunización vía oral con diferentes vehículos y diferente dosis.
Algunos trabajos resaltan el mejor desempeño de la inoculación por vía oral (inclusive feedback) contra la vía intramuscular. Sin embargo, ambos protocolos pueden ser ineficientes debido a: 1) no existen protocolos estandarizados de feedback; 2) la pobre capacidad de las actuales vacunas intramusculares de inducir inmunidad lactogénica; 3) la diferencia antigénica de la vacuna vs las cepas epidémicas; y 4) la posible y continua reinfección de PED por el uso de feedback27.
El presente estudio demostró que los vehículos que mejores resultados presentaron fueron el inóculo con agua y el inóculo directo combinado con la dosis de 1 ml, ya que la combinación de estos vehículos y dosis con el inóculo generó que más del 90 % de las cerdas seroconvirtieran a partir de la segunda semana post-inoculación.











 texto en
texto en 


