Introducción
La familia Odontophoridae es un grupo de aves terrestres exclusivas del continente americano, también llamadas codornices del nuevo mundo. Cuenta con nueve géneros y 32 especies (Mesta et al. 2011). La mayoría de las especies de codornices del nuevo mundo ocurren en México, Centro América y la mitad norte de América del Sur. Su nombre se debe al enorme parecido con las codornices europeas (codornices del viejo mundo). Sin embargo, no están estrechamente relacionadas y se clasifican en diferentes familias (Mobley 2009). En México se distribuyen 15 especies de codornices clasificadas en ocho géneros (Hernández et al. 2014), lo que representa el 47% de la totalidad las especies y el 89% de los géneros. Además, México es considerado como el centro de la historia evolutiva y origen geográfico de estas especies, por lo que se identifica como un país de importancia para la conservación y diversidad de este grupo (Hernández et al. 2014).
Se desconocen muchos aspectos de la ecología básica e historia natural de la codornices mexicanas, y se carece de información actual sobre su estatus poblacional. Son escasos los estudios que abordan el estatus de conservación de las codornices mexicanas (e.g.Carroll y Eitniear 2000, Eitniear y Aragon 2004), a pesar de que seis de las 15 especies de codornices presentes en nuestro país se encuentra bajo estado de protección por la NOM-059-SEMARNAT (2010). La información disponible proviene de estudios realizados sobre especies que se distribuyen en América del Norte (Hernández et al. 2014). El problema se extiende a especies de importancia cinegética como la codorniz norteña (Colinus virginianus), codorniz escamosa (Callipepla squamata), codorniz de California (Callipepla californica) y codorniz de Gambel (Callipepla gambelii) (Hernández et al. 2014).
En México se permite la caza de nueve especies de codornices en 29 estados de la República. La cacería y el ecoturismo son actividades económicas emergentes para el país, principalmente en los estados del norte, donde miles de codornices son cazadas anualmente. Sin embargo, no existe una regulación apropiada de esta actividad en el país que garantice un aprovechamiento adecuado. Los desafíos que enfrenta la conservación y el manejo de las codornices son: las limitaciones propias del modelo de UMA (unidades de manejo para la conservación de la vida silvestre), la caza ilícita, la pérdida de hábitat y la incongruencia entre las legislación de cosecha y la conservación (Contreras-Gil et al. 2007, Hernández et al. 2014).
Por otra parte, existe una limitante escasamente abordada y que se refiere al uso reciente del nivel taxonómico de subespecie como unidad en la conservación y gestión de especies (Eo et al. 2010). El problema radica en que muchas subespecies de aves reflejan únicamente la variación geográfica de caracteres fenotípicos. En estos casos, la nomenclatura subespecífica representa de forma subjetiva un patrón de división clinal (Zink et al. 2016). Por ejemplo, se han reconocido 22 subespecies nominales de la codorniz norteña (Colinus virginianus), identificadas por la variación geográfica del plumaje masculino. Sin embargo, el análisis genético de cuatro de las subespecies encontró poca estructura genética que no fue compatible con los límites de las subespecies como unidades significativas para su manejo y conservación. Los resultados sugieren que tres (c.v. virginianus, c.v. marilandicu y c.v. mexicanus) de las cuatro subespecies podrían fusionarse como una sola unidad de manejo separadas de la subespecie c.v. floridanus (Eo et al. 2010).
La codorniz de California (C. californica) con distribución en la costa occidental de Norteamérica desde Columbia Británica, Canadá, a la península de Baja California, México (Calkins et al. 2014), es una de estas especies norteñas que destacan por su aprovechamiento cinegético, especialmente en la porción noroeste mediterránea (Koford 1987). Esta codorniz es gregaria, de tamaño mediano (machos: 260-270 mm, hembras: 241-266 mm) y con dimorfismo sexual marcado; el macho es ligeramente más grande que la hembra. Siete subespecies nominales de C. californica han sido descritas, cuatro de ellas se encuentran en la península de Baja California: C.c. californica [= vallicola], C.c. plumbea, C.c. decolorata y C.c. achrustera, definidas a través de un gradiente latitudinal y climático (Grinnell 1928, Van Rossem 1946, Wilbur 1987, Calkins et al. 2014). La codorniz de California presenta variaciones morfológicas y cromáticas a lo largo de su distribución geográfica, con una aparente asociación de la coloración con las condiciones climáticas prevalecientes, siendo el color más claro en climas tropicales que en el clima mediterráneo (Ridgway y Friedmann 1946, Van Rossem 1946).
La diferenciación fenotípica entre las subespecies de la codorniz de California ha sido fundamentada en el tamaño corporal, coloración del dorso, pecho y alas, así como tamaño y tonalidad del parche ventral (Van Rossem 1939, 1946; Ridgway y Friedmann 1946). Sin embargo, más allá de los estudios realizados para la descripción de las subespecies peninsulares que fueron basados en un limitado número de caracteres, no existen estudios que hayan evaluado y comparado cuantitativamente la variación fenotípica de las subespecies de C. californica de la península de Baja California.
La diferenciación y estructura poblacional genética de la codorniz de California fue analizada utilizando aloenzimas (Zink et al. 1987). Los resultados indicaron una leve variación genética entre las poblaciones de California y Baja California con excepción de la población continental de Tule Lake, que fue genéticamente más similar a las poblaciones peninsulares de Baja California que otras poblaciones vecinas geográficamente. Adicionalmente, se estimó que su dispersión desde el sureste de California hacia la península de Baja California fue aproximadamente entre 3 y 5 millones de años (Zink et al. 1987). Más recientemente y utilizando secuencias de ADN nuclear y mitocondrial, Vázquez-Miranda (2014) calculó que la divergencia desde el continente de la comunidad de aves en la península de Baja California se dio en tres eventos. El segundo evento ocurrió en el Pleistoceno temprano hace aproximadamente 0.92 millones de años, momento en el cual especies como C. californica divergieron del continente.
En virtud de lo anterior, comparamos estadísticamente 18 caracteres morfométricos y de coloración entre las subespecies nominales de Callipepla californica de la península de Baja California, con el propósito de evaluar su valor diagnóstico para la discriminación taxonómica infraespecífica.
Métodos
Para el análisis comparativo de las características morfométricas y cromáticas de las subespecies nominales de C. californica obtuvimos datos de 338 especímenes de museo, de los cuales 325 proceden de 107 localidades de la península de Baja California y otros 13 individuos proceden de siete localidades de California, EUA. (Figura 1 y Anexo 1). Los especímenes examinados fueron de las siguientes colecciones ornitológicas: Universidad Autónoma de Baja California (UABC, n = 54), Museo de Historia Natural de San Diego (SDNHM, n = 103), Museo de Zoología de Vertebrados de la Universidad de California Berkeley (MVZ, n = 131) y Academia de Ciencias de San Francisco (CAS, n = 50).
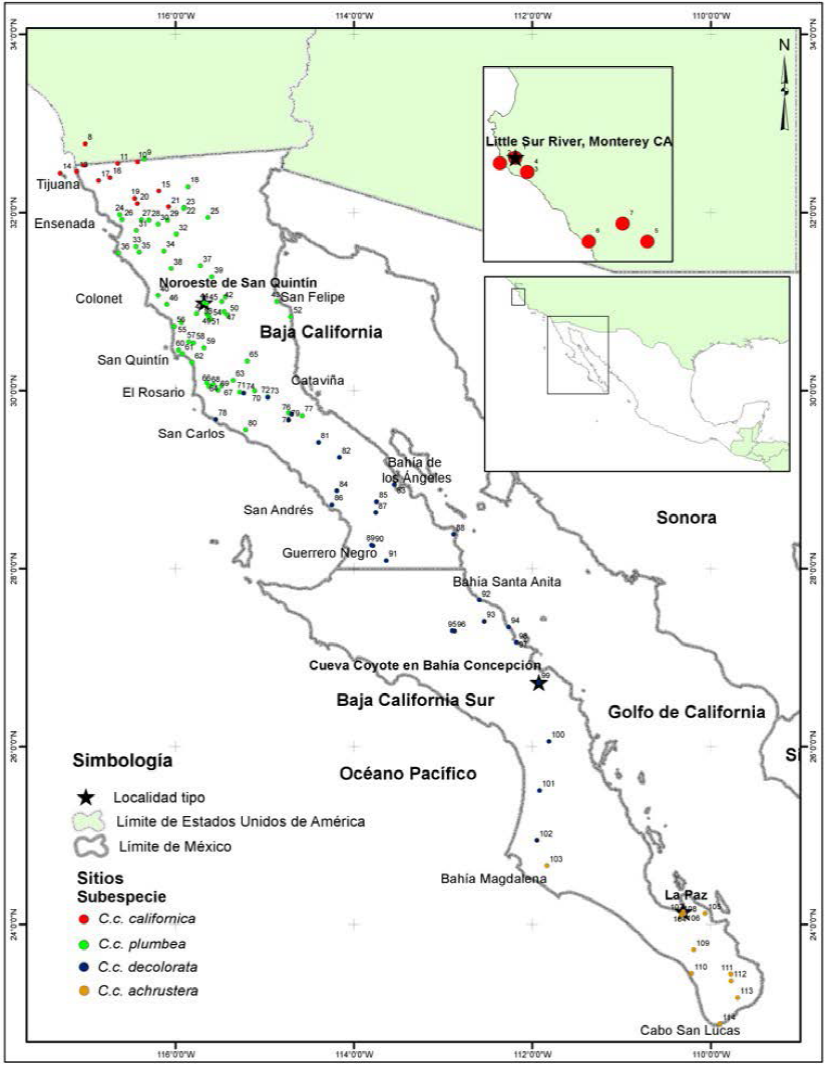
Figura 1 Sitios de muestreo de las subespecies Callipepla californica, C.c. plumbea, C.c. decolorata y C.c. achrustera en la península de Baja California, México y de la localidad tipo de la subespecie C.c. californica en Monterey California, Estados Unidos de América. Los números corresponden a los sitios detallados en el Anexo 1.
Los especímenes que analizamos fueron seleccionados con base en los siguientes criterios: buena condición general del espécimen y calidad del plumaje, organismos con plumaje completo de adulto, identificado taxonómicamente a nivel de subespecie en la colección con excepción de los organismos de la colección de aves de la UABC, los cuales identificamos a nivel de subespecie con base en los criterios descritos en el Cuadro 1.
Cuadro 1 Descripción de los criterios utilizados para la clasificación taxonómica de los especímenes en subespecies y delimitación de las localidades tipo. Las medidas somáticas expresadas en milímetros.
| Subespecie | Criterios de Clasificación Taxonómica Usados | Referencias |
|---|---|---|
| C.c. californica (Shaw y Nodder 1798) | Codorniz del valle de California | |
| Distribución: Residentes en el interior semiárido de California. En la península de Baja California se han reportado en Tijuana, Tecate, sur del valle de las Palmas y en las Islas Coronado. | Grinnell 1931 Ridgway y Friedmann 1946 | |
| General: Color marrón grisáceo más oscuro que las subespecies de zonas áridas pero más claro que C.c. brunnescens. | ||
| Macho Adulto: Dorso en promedio más café que gris en plumaje fresco Figura 2A y pecho de color gris neutro más oscuro que C.c. achrusteraFigura 3A pero más pálido que la subespecie C.c. brunnescens. | ||
| Medidas promedio (mm): Ala 110.6; Cola 89.2; Culmen 15.1; Tarso 32.9 y Dedo medio 27.4. | ||
| Hembra Adulto: Dorso como los machos Figura 4A y pecho café ante grisáceo en plumaje fresco Figura 5A. | ||
| Medidas promedio (mm): Ala 107.8; Cola 83.8; Culmen 14.8; Tarso 30.4 y Dedo medio 26 | ||
| Localidad Tipo: Monterey, California, Estados Unidos de América. | ||
| Coordenadas propuestas 36°20’24”'N, 121°48’09”O, altitud 261 msnm del sitio Little Sur River, Monterey, CA. Figura 1. | ||
| C.c. plumbea (Grinnell 1926) | Codorniz del valle de San Quintín | |
| Distribución: Residentes en chaparral abierto desde suroeste del condado de San Diego al noroeste de Baja California, alrededor de la latitud 30°N. | Grinnell, 1926 Ridgway y Friedmann,1946 | |
| General: Tono de coloración menos pardo, gris plomo en dorso, pecho y flancos, pero más oliváceo en las alas. | ||
| Macho Adulto: Dorso más gris en plumaje fresco con poca o nula fusión marrón Figura 2B y pecho de color gris neutro Figura 3B más oscuro que C.c. orecta. | ||
| Medidas promedio (mm): Ala 107.3; Cola 83; Culmen 14.5; Tarso 30.9 y Dedo medio 25.8. | ||
| Hembra Adulto: Dorso evidentemente gris menos marrón Figura 4B, pecho de color gris ratón Figura 5B opuesto al color grisáceo en C.c. achrusteraFigura 5D. | ||
| Medidas promedio (mm): Ala 105.3; Cola 82.2; Culmen 14.5; Tarso 29.8 y Dedo medio 25. | ||
| Localidad Tipo: San Quintín Baja California, México (Holotipo # 46206 MVZ, espécimen no disponible). | ||
| Coordenadas propuestas 30°59’N, 115°41”W, altitud 762 msnm, del sitio San José alrededor 45 millas Noreste de San Quintín, cerca de 31° latitud N, BC, México. Figura 1. | ||
| C.c. decolorata (Van Rossem 1946) | Codorniz del centro de la península | |
| Distribución: Residentes en Baja California desde la latitud 25°N hasta 30°N. | Van Rossem 1946 | |
| General: Gris más uniforme caracterizado por una casi ausencia de tonos oliváceos en el dorso y tonos marrones en los costados y flancos. | ||
| Machos: Dorso gris casi ausentes tonos oliva y marrón en los costados Figura 2C y parche ventral amarillo más pálido Figura 3C. | ||
| Medidas promedio (mm): Ala 107.16; Cola 91.88; Culmen 13.26; Tarso 32.59 y Dedo medio 26.05 (datos propios). | ||
| Hembras: Tono pálido similar a las subespecies C.c. achrustera y C.c. canfieldae pero difiere por la ausencia de tonos pardos y oliváceos Figuras 4C y 5C. | ||
| Localidad Tipo: Bahía Concepción, Baja California Sur, México. | ||
| Coordenadas propuestas: 26°43’13”N, 111°55’44”O, altitud 267 msnm del sitio Isla en Cueva Coyote, Bahía Concepción, BCS, México. Figura 1. | ||
| Medidas promedio (mm): Ala 103.40 Cola 89.43; Culmen 12.97; Tarso 31.79 y Dedo medio 25.44 (datos propios). | ||
| C.c. achrustera (Peters 1923) | Codorniz de San Lucas | |
| Distribución: Residentes en la parte sur de península de Baja California, desde Cabo San Lucas a la latitud 25°N. | Ridgway y Friedmann 1946 | |
| General: Similar a la C.c. canfieldae pero menos pálida. | ||
| Machos: Dorso oscuro en promedio más gris que café en plumaje fresco Figura 2D (lo opuesto para C.c. californica). Pecho gris neutro profundo más oscuro que C.c. plumbea. Figura 3D. | ||
| Medidas promedio (mm): Ala 110; Cola 91; Culmen 15.4; Tarso 31.2 y Dedo medio 25.8 | ||
| Hembras: Dorso más grisáceo que pardusco Figura 4D y pecho grisáceo a gris claro Figura 5D. | ||
| Medidas promedio (mm): Ala 106; Cola 84.9; Culmen 15; Tarso 30.2 y Dedo medio 24.8 | ||
| Localidad Tipo: La Paz, Baja California Sur, México. | ||
| Coordenadas propuestas 24°08’32”N, 110°18’39”O, altitud 32.57 msnm del sitio La Paz, BCS. México. Figura 1. |
Referenciamos los datos históricos de las etiquetas a través de las bases de datos GBIF (2016), Arctos (2016), VertNet (2016) y Ruiz-Campos et al. (2004), lo cual permitió verificar la ubicación de los sitios de colecta y actualizar la nomenclatura de identificación taxonómica en los casos necesarios. En el análisis comparativo de especímenes entre subespecies, se incluyeron todos los individuos identificados a nivel de subespecie en las colecciones ornitológicas, además de los identificados taxonómicamente en este estudio. Los criterios utilizados se detallan en el apartado identificación taxonómica.
En el análisis comparativo de especímenes entre localidades tipo de las subespecies peninsulares, incluimos especímenes de referencia de la subespecie norteña C.c. californica. Las localidades tipo son aquellos sitios de donde proceden los especímenes utilizados para la descripción original de la subespecie en cuestión de acuerdo con Grinnell (1926, 1931), Ridgway y Friedmann (1946) y Van Rossem (1946).
Identificación taxonómica infraespecífica
Cada individuo que examinamos fue asignado a la subespecie correspondiente basado en la información contenida en su etiqueta y corroborado con la distribución de la subespecie en cuestión. Confirmamos la identificación de cada individuo a nivel subespecífico con base en la distribución geográfica conocida previamente y el patrón de color del plumaje según el sexo (Cuadro 1 y Figuras 2, 3, 4 y 5), utilizando los criterios de Grinnell (1926, 1931), Ridgway y Friedmann (1946) y Van Rossem (1946). Así mismo, identificamos aquellos individuos de los sitios reconocidos como localidades tipo de las diferentes subespecies peninsulares (Figura 1 y Cuadro 1).

Figura 2 Vista dorsal de especímenes machos de las subespecies de Callipepla californica presentes en la península de Baja California. Los incisos corresponden: a) espalda alta, b) espalda baja, c) cola y d) ala derecha e izquierda. 2A Espécimen CAS # 58760 colectado por D.A. Cohen el 14 de diciembre 1925; 2B Espécimen MVZ # 46213 colectado por Chester C. Lamb el 23 de octubre de 1925; 2C Espécimen SDNHM # 15251 colectado por J. Elton Green el 26 de marzo de 1930; 2D Espécimen MVZ # 45146 colectado por Chester C. Lamb el 15 de octubre de 1924.

Figura 3 Vista ventral de especímenes machos de las subespecies de Callipepla californica presentes en la península de Baja California. Los incisos corresponden: e) pecho, f) parche amarillo y g) parche café. 3A Espécimen CAS # 58760 colectado por D.A. Cohen el 14 de diciembre 1925; 3B Espécimen MVZ # 46213 colectado por Chester C. Lamb el 23 de octubre de 1925; 3C Espécimen SDNHM # 15251 colectado por J. Elton Green el 26 de marzo de 1930; 3D Espécimen MVZ # 45146 colectado por Chester C. Lamb el 15 de octubre de 1924.

Figura 4 Vista dorsal de especímenes hembras de las subespecies de Callipepla californica presentes en la península de Baja California. Los incisos corresponden: a) espalda alta, b) espalda baja, c) cola y d) ala derecha e izquierda. 4A Espécimen CAS # 58761 colectado por D.A. Cohen el 14 de diciembre 1925; 4B Espécimen MVZ # 46212 colectado por Chester C. Lamb el 19 de octubre de 1925; 4C Espécimen MVZ # 50754 Colectado por Chester C. Lamb el 9 de mayo de 1927; 4D Espécimen MVZ # 45145 colectado por Chester C. Lamb el 11 de octubre de 1924.

Figura 5 Vista ventral de especímenes hembras de las subespecies de Callipepla californica presentes en la península de Baja California. Los incisos corresponden: e) pecho y f) abdomen. 5A Espécimen CAS # 58761 colectado por D.A. Cohen el 14 de diciembre 1925; 5B Espécimen MVZ # 46212 colectado por Chester C. Lamb el 19 de octubre de 1925; 5C Espécimen MVZ # 50754 Colectado por Chester C. Lamb el 9 de mayo de 1927; 5D Espécimen MVZ # 45145 colectado por Chester C. Lamb el 11 de octubre de 1924.
Medidas corporales y de color
Seleccionamos las variables con base en los caracteres morfométricos propuestos por Pyle et al. (1997) y caracteres colorimétricos referidos en Grinnell (1926), Ridgway y Friedmann (1946) y Van Rossem (1946). Con el uso de un vernier digital (precisión 0.01 mm) tomamos nueve medidas morfológicas (mm) basadas en Pyle et al. (1997) (Cuadro 2, Figuras 6A y 6B).
Cuadro 2 Caracteres morfométricos y colorimétricos cuantificados para las poblaciones de Callipepla californica en la península de Baja California, México y California, EUA. (Véase Figura 6 para puntos de referencia).
| Código | Caracter morfométrico | Código | Caracter Cromático |
|---|---|---|---|
| WCL | Longitud de la cuerda del ala derecha | Br | Luminosidad del pecho |
| TiL | Longitud de la cola | TPM | Luminosidad del parche amarillo |
| TrL | Longitud del tarso derecho | BPM | Luminosidad del parche café |
| MTo | Longitud dedo medio derecho | UBa | Luminosidad de la espalda alta |
| ML | Longitud de la mandíbula | LBa | Luminosidad de la espalda baja |
| BeLN | Longitud del pico desde la nostrila a la punta | TB | Luminosidad de la cola |
| BeW | Ancho del pico | RF | Luminosidad del flanco derecho |
| BeD | Alto de pico | LF | Luminosidad del flanco izquierdo |
| ECL | Longitud del culmen expuesto | ABF | Luminosidad del abdomen |
MCaracter sólo para machos. F Caracter sólo para hembras.
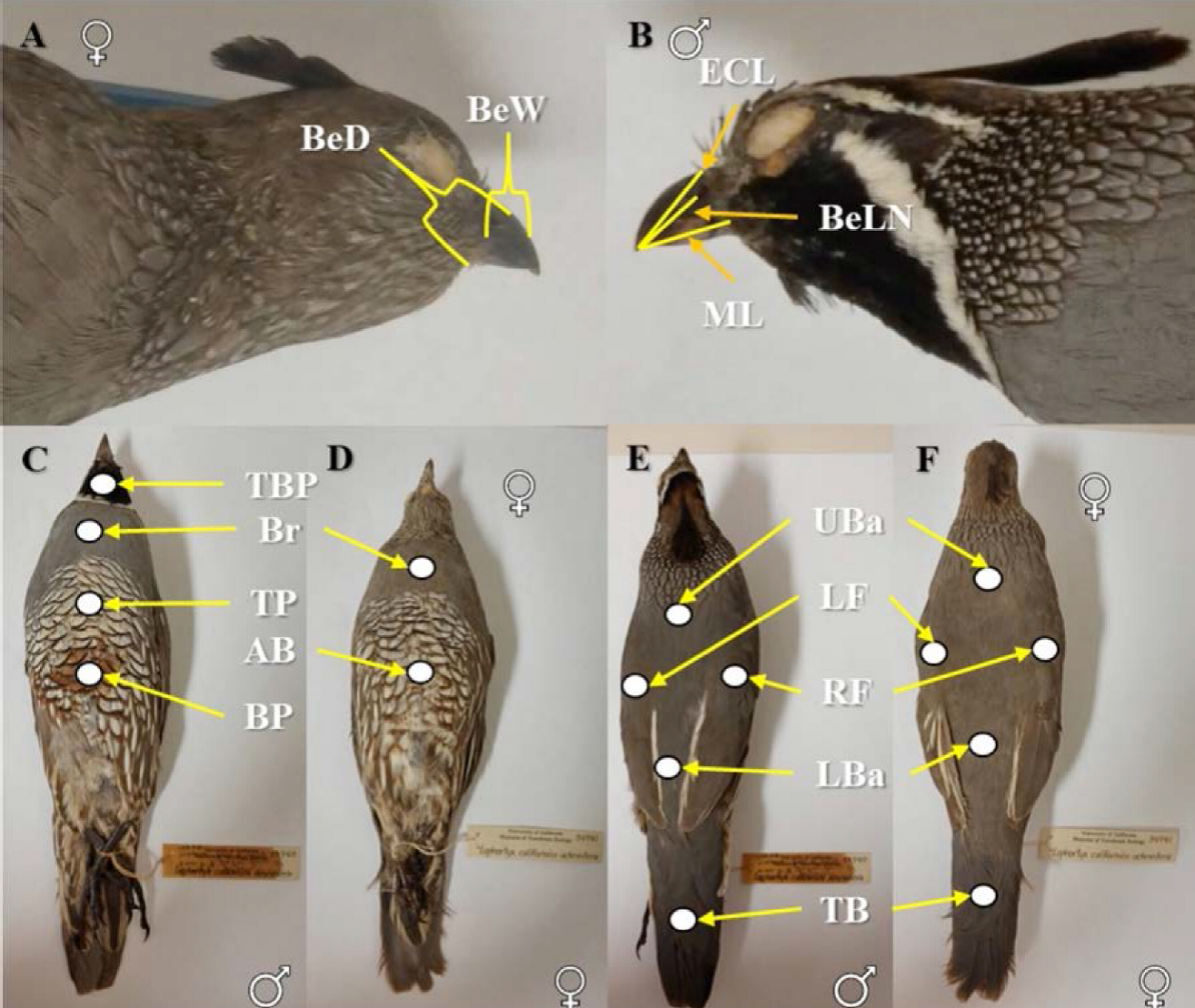
Figura 6 Puntos de referencia de las medidas morfométricas y colorimétricas de los especímenes de Callipepla californica analizados. A y B) corresponden a las medidas del pico analizadas. C, D, E y F) corresponden a las medidas de color analizadas. A, D y F corresponden a hembras mientras que B, C y E corresponden a machos de Callipepla californica.
Realizamos la medición del color de los especímenes cuantitativamente utilizando un colorímetro Minolta (Japón) Modelo CR-300, el cual mide el espectro reflectante de la superficie del plumaje en un diámetro de 8 mm. Tomamos nueve medidas de color para machos y siete medidas de color para hembras (Cuadro 2 y Figuras 6C, 6D, 6E, 6F) con base en los caracteres específicos utilizados para la identificación taxonómica de las subespecies de Grinnell (1926), Ridgway y Friedmann (1946) y Van Rossem (1946) y que se detallan en el Cuadro 1 y Figuras 2, 3, 4 y 5. El análisis colorimétrico lo llevamos a cabo usando la configuración del método CIELAB 1976 (Minolta 1991), el cual expresa el color y luminosidad de un objeto a través de un atributo numérico objetivo. Este atributo se calcula como CIE = L*a*b*, donde: L* = luminosidad; a* = coordenadas rojo/verde (valores positivos +a indica rojo y valores negativos -a indica verde); b* = coordenadas amarillo/azul (+b indica amarillo y -b indica azul) (Minolta 1991). Al usar el espacio de color L*a*b*, sólo es posible comparar el atributo de luminosidad, L. Para este análisis únicamente incluimos los especímenes de las colecciones ornitológicas de SDNHM, MVZ y CAS.
El uso de especímenes de colección es apropiado para el análisis de color. Esto incluye a ejemplares de distintas décadas, ya que estudios independientes sobre el desvanecimiento de color en especímenes de museo determinaron que, aun existiendo decoloración entre ejemplares, esto no fue causa suficiente para una mala interpretación. La decoloración en especímenes antiguos (con más de 150 años) no afectó la tonalidad, sólo la luminosidad (McNaught et al. 2002). Por lo que, con base en esta información, trabajamos bajo el supuesto de que no existió decoloración del plumaje por deterioro de los especímenes, ya que los ejemplares pueden conservarse por muchas décadas (Rojas-Soto et al. 2002). El intervalo de años entre los ejemplares analizados colorimétricamente para el presente estudio fue de 71 años (1893-1964). Los especímenes más antiguos correspondieron a dos ejemplares, 1 hembra y 1 macho, de la colección de aves de la Academia de Ciencias de San Francisco (CAS 73800 y CAS 73801, respectivamente); que se colectaron el 6 de julio de 1893, en rancho San Antonio, Sierra de San Pedro Mártir. El espécimen más reciente analizado en nuestro estudio fue una hembra de la colección de aves del Museo de Historia Natural de San Diego, colectado el 31 de diciembre de 1964, en rancho Escondido, Baja California (SDNHM 35277).
Análisis estadístico
Análisis de componentes principales
Realizamos un análisis de componentes principales (ACP) para identificar las variables fenotípicas más importantes en la formación de grupos y para determinar el patrón de variación de caracteres fenotípicos (morfométricos y coloración) entre las subespecies. Este método estadístico permite determinar la contribución de un conjunto de variables intercorrelacionadas (componentes principales) sobre un problema sin la pérdida de información (Aldás y Uriel 2017).
La variable subespecie se utilizó como una variable suplementaria en el análisis con la finalidad de corroborar que los especímenes identificados como C.c. californica, C.c. plumbea, C.c. decolorata y C.c. achrustera, correspondieran a grupos en el espacio multivariado y de esta manera determinar unidades de comparación.
Análisis comparativo de especímenes a través del Análisis Función Discriminante
Utilizamos un análisis estadístico de función discriminante (AFD) de paso por paso hacia adelante para evaluar la variación de caracteres fenotípicos (morfométricos y coloración) de los especímenes clasificados a priori a nivel de subespecies y de localidades tipo, para determinar la combinación de variables que discriminan mejor entre las subespecies y entre las localidades tipo. Utilizamos el programa Statistica 7.0 (StatSoft, Inc., EUA), considerando como variables de agrupamiento a las subespecies y localidades tipo, respectivamente. Las variables independientes seleccionadas fueron nueve morfométricas y nueve de coloración. Todas las medidas anatómicas y de color fueron tomadas por triplicado para cada ejemplar, cuyos valores promedio y desviación estándar se presentan en el Anexo 2.
Además, para la delimitación de los sitios considerados en la categoría de localidades tipo, efectuamos análisis de función discriminante entre las subespecies, identificando de modo radial aquellos sitios que permitieron una discriminación adecuada.
En el AFD se mide el poder de discriminación entre grupos usando la Lambda de Wilks, cuyos valores oscilan entre 0.0 (discriminación completa) y 1.0 (ausencia de discriminación). En este mismo análisis se determinan los coeficientes estandarizados de las variables canónicas (raíces) que indican el poder de discriminación de cada variable en el análisis global. Adicionalmente, construimos dendrogramas de agrupamiento basado en la matriz de distancias cuadráticas de Mahalanobis (D2) de las variables morfométricas y cromáticas entre los grupos (subespecies o localidades tipo) comparados.
Resultados
Determinación de unidades de comparación
En este estudio las unidades de comparación fueron basadas en las categorías de análisis previamente seleccionadas (Subespecie taxonómica y Localidad Tipo de la subespecie), con base en la información disponible de la literatura y en el examen de especímenes de las colecciones ornitológicas consideradas. Los resultados del análisis de componentes principales para determinación de unidades de comparación fueron los siguientes:
Machos: El análisis incluyó 201 individuos que se clasificaron con un 95% de confianza en un grupo subdividido en dos claramente definidos (Figura 7A). Ambos grupos incluyeron especímenes de todas las subespecies taxonómicas (C.c. californica, C.c. plumbea, C.c. decolorata y C.c. achrustera). Por otra parte, los machos de las localidades tipo (29 individuos) formaron un solo grupo heterogéneo y no se observó una subdivisión (Figura 7C). El traslape entre los especímenes machos de las subespecie se puede observar en las Figuras 10A y 10C con sus respectivos límites de confianza (95%).
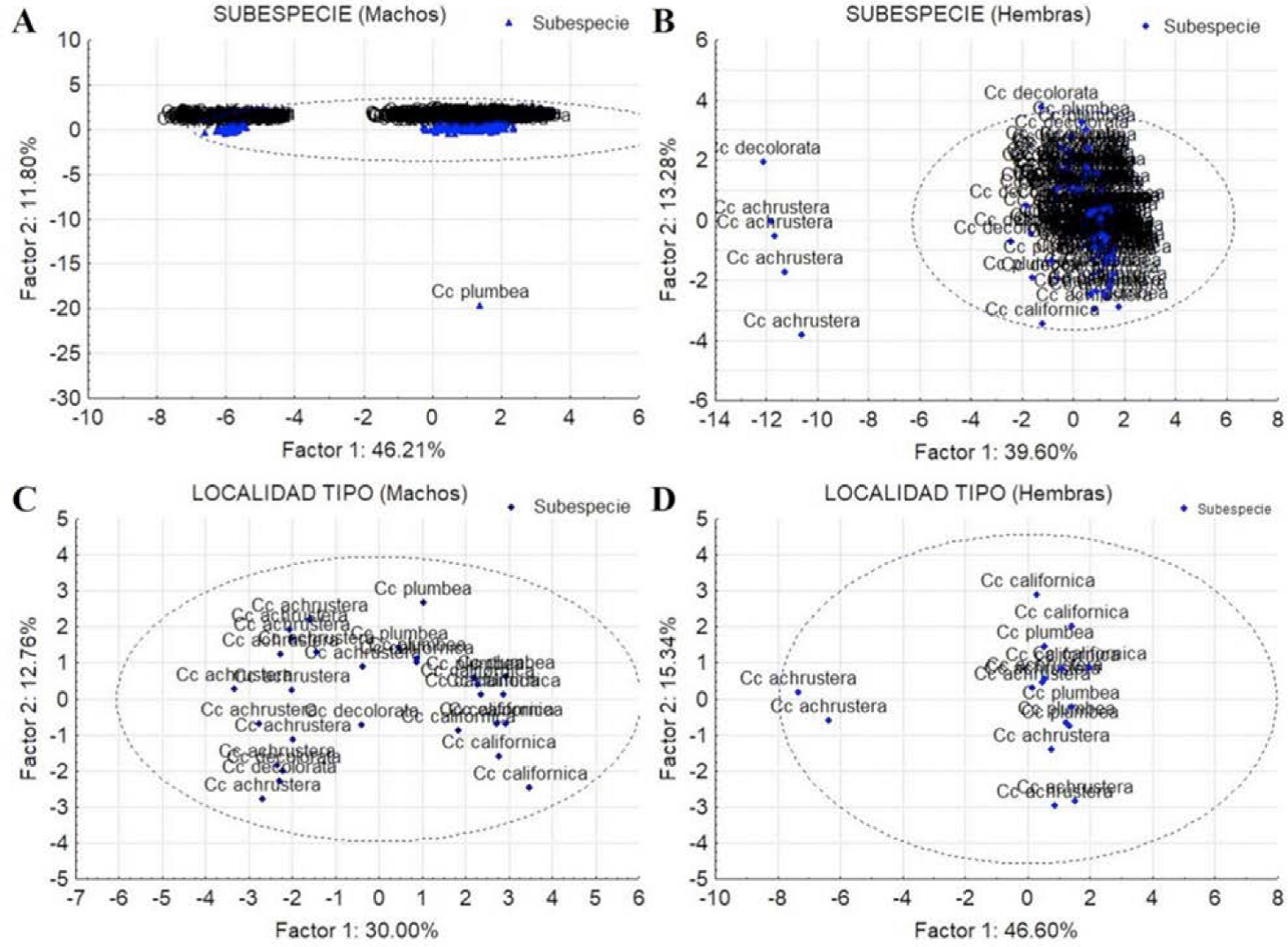
Figura 7 Diagrama de dispersión de componentes principales de las poblaciones de Callipepla californica separados por sexo y categoría. A) Machos por subespecie, B) Hembras por subespecie, C) Machos por localidad tipo y D) Hembras por localidad tipo. El factor 1 y 2 indica el porcentaje de variación explicada por el mismo, la elipse indica el límite de confianza a 95%.
Hembras: El análisis incluyó 115 individuos que, al igual que los machos, se clasificaron con un 95% de confianza en un solo grupo heterogéneo que incluyó todas las subespecies. Sin embargo se registraron 5 individuos fuera del grupo (Figura 7B). De igual forma, las hembras de las localidades tipo (16 individuos) se agruparon en un solo conjunto (Figura 7D). El traslape entre los especímenes hembras de las subespecies se puede observar en las Figuras 10B y 10D con sus respectivos límites de confianza de 95%.
Identificación de caracteres fenotípicos a través del análisis de componentes principales
Los resultados de los análisis de componentes principales (ACP) para la identificación de los caracteres fenotípicos más importantes en la formación de grupos para machos y hembras se muestran a continuación:
Machos: Los dos primeros factores explican el 58.1% de la varianza; el factor 1 explicó el 46.21% y el factor 2 el 11.80% (Cuadro 3). El factor 1 está integrado por las ocho variables de coloración (Br, TP, BP, UBa, LBa, TB, RF, LF); mientras que el factor 2 está determinado por el ancho y alto del pico (BeW y BeD) (Cuadro 3, 4 y Figura 8A).
Cuadro 3 Autovalores, varianza total (%), autovalores acumulados y acumulado (%) obtenidos del Análisis de Componentes Principales de las medidas fenotípicas (morfométricas y colorimétricas) de poblaciones de Callipepla californica en la península de Baja California y California, EUA: Machos totales (n = 201), hembras totales (n = 121) y por localidad tipo: machos (n = 29) y hembras (n = 16).
| SUBESPECIE | Autovalores | Varianza total % | Autovalores Acumulados | Acumulado % | SUBESPECIE | Autovalores | Varianza total % | Autovalores acumulados | Acumulado % |
|---|---|---|---|---|---|---|---|---|---|
| Sexo | Machos | Machos | Machos | Machos | Sexo | Hembras | Hembras | Hembras | Hembras |
| Morfométricos | Morfométricos | ||||||||
| WCL | 7.855986 | 46.2168 | 7.85599 | 46.2117 | WCL | 6.336420 | 39.60262 | 6.33642 | 39.6026 |
| TiL | 2.005985 | 11.7991 | 9.86197 | 58.0116 | TiL | 2.124591 | 13.27869 | 8.46101 | 52.8813 |
| TrL | 1.509283 | 8.87813 | 11.37125 | 66.8897 | TrL | 1.290807 | 8.06754 | 9.75182 | 60.9489 |
| MTo | 1.161456 | 6.83210 | 12.53271 | 73.7218 | MTo | 1.100642 | 6.87902 | 10.85246 | 67.8279 |
| ML | 1.075653 | 6.32737 | 13.60836 | 80.0492 | ML | 1.065702 | 6.66064 | 11.91816 | 74.4885 |
| BeLN | 1.010500 | 5.94412 | 14.618886 | 85.9933 | BeLN | 0.774675 | 4.84172 | 12.69284 | 79.3302 |
| ECL | 0.814242 | 4.78966 | 15.43311 | 90.7830 | ECL | 0.742088 | 4.63805 | 13.43393 | 83.9683 |
| BeW | 0.595374 | 3.50220 | 16.02848 | 94.2852 | BeW | 0.699143 | 4.36964 | 14.13407 | 88.3379 |
| BeD | 0.365854 | 2.15208 | 16.39433 | 96.4373 | BeD | 0.564205 | 3.52628 | 14.69827 | 91.8642 |
| Colorimétricos | Colorimétricos | ||||||||
| Br | 0.194570 | 1.14453 | 16.58890 | 97.5818 | Br | 0.526657 | 3.29160 | 15.22493 | 95.1558 |
| TP | 0.170076 | 1.00045 | 16.75898 | 98.5822 | AB | 0.389194 | 2.43246 | 15.61412 | 97.5883 |
| BP | 0.082031 | 0.48253 | 16.84101 | 99.0648 | UBa | 0.156000 | 0.97500 | 15.77012 | 98.5633 |
| UBa | 0.049167 | 0.28922 | 16.89018 | 99.3540 | LBa | 0.132033 | 0.82521 | 15.90216 | 99.3885 |
| LBa | 0.034782 | 0.20460 | 16.92496 | 99.5586 | TB | 0.082921 | 0.51263 | 15.98418 | 99.9011 |
| TB | 0.033646 | 0.19792 | 16.92496 | 99.7565 | RF | 0.010902 | 0.06814 | 15.99508 | 99.9693 |
| RF | 0.028625 | 0.16838 | 16.98723 | 99.9249 | LF | 0.004920 | 0.03075 | 16.00000 | 100.000 |
| LF | 0.012769 | 0.07511 | 17.00000 | 100.000 | |||||
| LOCALIDAD TIPO | Autovalores | Varianza total % | Autovalores acumulados | Acumulado % | LOCALIDAD TIPO | Autovalores | Varianza total % | Autovalores acumulados | Acumulado % |
| Sexo | Machos | Machos | Machos | Machos | Hembras | Hembras | Hembras | Hembras | Hembras |
| Morfométricos | Morfométricos | ||||||||
| WCL | 5.100087 | 30.00051 | 5.10009 | 30.0005 | WCL | 7.456747 | 46.60467 | 7.45675 | 46.6047 |
| TiL | 2.168509 | 12.75593 | 7.26860 | 42.7564 | TiL | 2.453929 | 15.33706 | 9.91068 | 61.9417 |
| TrL | 1.826309 | 10.74299 | 9.09490 | 53.4994 | TrL | 2.058310 | 12.86444 | 11.96899 | 74.8062 |
| MTo | 1.429691 | 8.40995 | 10.52460 | 61.9094 | MTo | 1.251135 | 7.81960 | 13.22012 | 82.6258 |
| ML | 1.321641 | 7.77436 | 11.84624 | 69.6837 | ML | 0.831181 | 5.19488 | 14.05130 | 87.8206 |
| BeLN | 1.152334 | 6.77844 | 12.99857 | 76.4622 | BeLN | 0.687245 | 4.29528 | 14.73855 | 92.1159 |
| ECL | 0.917750 | 5.39853 | 13.91632 | 81.8607 | ECL | 0.541393 | 3.38271 | 15.27994 | 95.4996 |
| BeW | 0.695943 | 4.09378 | 14.61226 | 85.9545 | BeW | 0.302469 | 1.89043 | 15.58341 | 97.3901 |
| BeD | 0.635878 | 3.74046 | 15.24814 | 89.6950 | BeD | 0.185460 | 1.15913 | 15.76787 | 98.5492 |
| Colorimétricos | Colorimétricos | ||||||||
| Br | 0.486231 | 2.86018 | 15.73473 | 92.5551 | Br | 0.143791 | 0.89869 | 15.91166 | 99.4479 |
| TP | 0.380327 | 2.23722 | 16.11470 | 94.7924 | AB | 0.064812 | 0.40508 | 15.97647 | 99.8530 |
| BP | 0.304318 | 1.79011 | 16.41902 | 96.5825 | UBa | 0.016199 | 0.10124 | 15.99267 | 99.9542 |
| UBa | 0.234140 | 1.37729 | 16.65316 | 97.9598 | LBa | 0.005761 | 0.03601 | 15.99843 | 99.9902 |
| LBa | 0.147637 | 0.86845 | 16.80080 | 98.8282 | TB | 0.001539 | 0.00962 | 15.99997 | 99.9998 |
| TB | 0.103185 | 060697 | 16.90398 | 99.4352 | RF | 0.000027 | 0.00017 | 16.00000 | 100.000 |
| RF | 0.069007 | 0.40592 | 16.97299 | 99.8411 | LF | ||||
| LF | 0.027012 | 0.15890 | 17.00000 | 100.000 |
Cuadro 4 Valor de correlación de cada variable y proporción de varianza explicada por cada factor, obtenidos del Análisis de Componentes Principales de las medidas fenotípicas (morfométricas y colorimétricas) de poblaciones de Callipepla californica en la península de Baja California y California, EUA: Machos totales (n = 201), hembras totales (n = 121) y por localidad tipo: machos (n = 29) y hembras (n = 16). Los factores 1 y 2 explicaron el mayor porcentaje de varianza observada. Valores significativos en negritas.
| Variable | SUBESPECIE | SUBESPECIE | LOCALIDAD TIPO | LOCALIDAD TIPO | Variable | SUBESPECIE | SUBESPECIE | LOCALIDAD TIPO | LOCALIDAD TIPO |
|---|---|---|---|---|---|---|---|---|---|
| MACHOS | HEMBRAS | ||||||||
| Factor 1 | Factor 2 | Factor 1 | Factor 2 | Factor 1 | Factor 2 | Factor 1 | Factor 2 | ||
| Morfométricos | Morfométricos | ||||||||
| WCL | 0.000524 | -0.084938 | 0.372089 | -0.506686 | WCL | 0.063481 | 0.374159 | 0.405625 | 0.555610 |
| TiL | -0.040086 | -0.150967 | -0.540589 | 0.059724 | TiL | -0.098878 | 0.470399 | 0.244787 | -0.421774 |
| TrL | -0.167163 | 0.082846 | 0.031255 | -0.585940 | TrL | 0.018815 | -0.0099316 | 0.161119 | 0.229396 |
| MTo | 0.088696 | 0.035539 | 0.112644 | 0.040765 | MTo | 0.007370 | 0.401681 | 0.272070 | 0.651474 |
| ML | -0.539448 | -0.036179 | -0.838457 | -0.164937 | ML | -0.036920 | 0.291663 | -0.366090 | -0.270280 |
| BeLN | -0.350676 | 0.060384 | -0.304433 | -0.842342 | BeLN | -0.412612 | 0.220226 | -0.367768 | 0.556514 |
| ECL | -0.332216 | -0.087418 | -0.508479 | -0.615534 | BeW | -0.288995 | 0.686769 | -0.281057 | 0.773088 |
| BeW | -0.060087 | -0.989023 | -0.770236 | 0.047703 | BeD | -0.417685 | 0684116 | -0.533256 | 0.513851 |
| BeD | -0.044886 | -0.987056 | -0.575176 | -0.307383 | ECL | -0.298702 | 0.620503 | -0.345872 | 0.380677 |
| Colorimétricos | Colorimétricos | ||||||||
| Br | -.0.974976 | 0.009959 | -0.861605 | 0.225706 | Br | -0.968237 | 0.101809 | -0.984082 | -0.110431 |
| TP | -0.974298 | 0.005546 | -0.785982 | 0.340932 | AB | -0.935754 | 0.003903 | -0.945512 | -0.090565 |
| BP | -0.970051 | 0.021536 | -0.402700 | -0.189443 | UBa | -0.974836 | -0.103290 | -0.984987 | -0.088962 |
| UBa | -0.975436 | 0.014497 | -0.415356 | 0.089143 | LBa | -0.807543 | -0.194616 | -0.812070 | 0.209945 |
| LBa | -0.911642 | 0.032148 | -0.359355 | 0.346474 | TB | -0.801793 | -0.195354 | -0.985610 | -0.073149 |
| TB | -0.895688 | 0.025615 | -0.068045 | -0.001403 | RF | -0.899916 | -0.168960 | -0.979609 | -0.092222 |
| RF | -0.977757 | 0.010671 | -0.822665 | 0.134170 | LF | -0.967017 | -0.134142 | -0.978227 | -0.121111 |
| LF | -0.952330 | 0.014278 | -0.414776 | -0.042139 | |||||
| Var. Explicada | 7.855986 | 2.005985 | 5.100087 | 2.168509 | Var. Explic. | 6.336420 | 2.124591 | 7.456747 | 2.453929 |
| Proporción Total | 0.462117 | 0.117999 | 0.300005 | 0.127559 | Prop. Total.. | 0.396026 | 0.132787 | 0.466047 | 0.153371 |
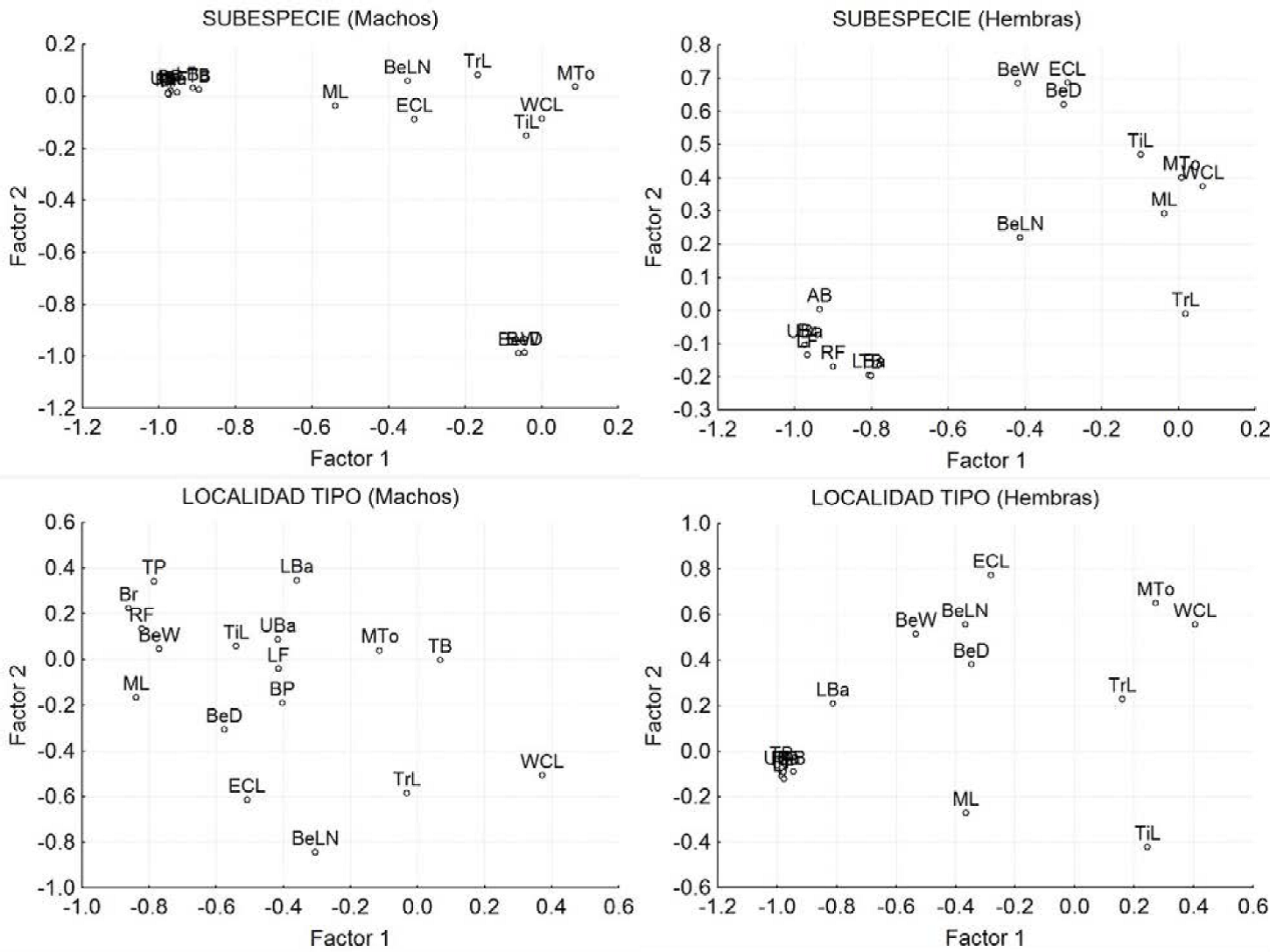
Figura 8 Diagrama de dispersión de las variables significativas de los componentes principales de las poblaciones de Callipepla californica separados por sexo y categoría. A) Machos por subespecie, B) Hembras por subespecie, C) Machos por localidad tipo y D) Hembras por localidad tipo.
Hembras: Los dos primeros factores explicaron el 52.88% de la varianza (Cuadro 3). El factor 1 con el 39.60% de la varianza está integrado, al igual que en los machos, por todas las medidas de color (Br, AB, UBa, LBa, TB, RF, LF); mientras que el Factor 2 no está determinado por ninguna medida en particular (Cuadro 3, 4 y Figura 8B).
Para la categoría de Localidad Tipo, la identificación los caracteres fenotípicos más importantes en la formación de grupos para machos y hembras, se encontró de la siguiente manera:
Machos: Los dos primeros factores explicaron el 42.76% de la varianza; el factor 1 explicó el 30% y el factor 2 el 12.76% (Cuadro 3). El factor 1 se define por la longitud de la mandíbula (ML), el ancho del pico (BeW) y por la luminosidad del pecho (Br), del parche amarillo (TP), y del flanco derecho (RF); mientras que el factor 2 está determinado por la longitud del pico medido desde la nostrila a la punta (BeLN) (Cuadro 3, 4 y Figura 8C).
Hembras: Los dos primeros factores explicaron el 61.94% de la varianza (Cuadro 3). El factor 1 con el 46.60% de la varianza está integrado por todas las medidas de color (Br, AB, UBa, LBa, TB, RF, LF); mientras que el Factor 2 con el 15.34% sólo está determinado por el ancho del pico BeW (Cuadro 3, 4 y Figura 8D).
Análisis comparativo de especímenes a través del AFD
Los resultados de los análisis de función discriminante (AFD) para la comparación de sexos a nivel de subespecies y de localidades tipo son los siguientes:
Comparación de subespecies por sexo
El AFD para machos incluyó 201 especímenes: 23 de a C.c. achrustera, 42 de C.c. decolorata, 109 de C.c. plumbea, y 27 de C.c. californica. Las siete variables seleccionadas por el análisis mostraron un valor global de Lambda de Wilks (λ) de 0.56 (P < 0.0001) e indica un nivel relativamente bajo de discriminación entre las subespecies. Sin embargo, de manera particular, hubo cinco variables que discriminaron de modo significativo (P < 0.01) entre las subespecies, las cuales fueron longitud de la mandíbula (ML, λ = 0.60), la longitud del pico desde la nostrila a la punta (BeLN, λ = 0.64), luminosidad del parche amarillo (TP, λ = 0.61), luminosidad del parche café (BP, λ = 0.58) y la luminosidad del flanco derecho (RF, λ = 0.58) (Cuadro 5). Los coeficientes estandarizados de la raíz canónica 1 explicaron el 76.9% de la variación total observada entre las subespecies, mientras que la raíz canónica 2 contribuyó con el 15.1% de la variación total observada (Cuadro 6). La clasificación predictiva de los individuos en los grupos fue de 61.69%, siendo de 8.7% para C.c. achrustera, 48% para C.c. decolorata, 91% para C.c. plumbea y 11% para C.c. californica.
Cuadro 5 Valores de Lambda de Wilks, nivel de P y tolerancia para las variables morfométricas y colorimétricas seleccionadas para el Análisis de Función Discriminante de poblaciones de Callipepla californica por grupos de análisis y por sexo en la península de Baja California y California, EUA: Machos totales (n = 201), hembras totales (n = 121) y por localidad tipo: machos (n = 29) y hembras (n = 16). Machos de subespecies: 7 pasos, variables en el modelo: 7, Lambda de Wilks: 0.55807, F (27,552) = 4.5245, P < 0.0000; Hembras de subespecies: 11 pasos, variables en el modelo: 11, Lambda de Wilks: 0.32130, F (33,315) = 4.5014, P < 0.0000; machos de localidad tipo: 7 pasos, variables en el modelo: 7, Lambda de Wilks: 0.01798, F (21,55) = 8.0117, P < 0.0000; hembras de localidad tipo: 3 pasos, variables en el modelo: 3, Lambda de Wilks: 0.12801, F (6,22) = 6.5816, P < 0.0004. Valores significativos en negritas.
| SUBESPECIE | Lambda de Wilks | Lambda parcial | Valor de F | Nivel de P | Tolerancia | Lambda de Wilks | Lambda parcial | Valor de F | Nivel de P | Tolerancia |
|---|---|---|---|---|---|---|---|---|---|---|
| Sexo | Machos | Machos | Machos | Machos | Machos | Hembras | Hembras | Hembras | Hembras | Hembras |
| Morfométricos | ||||||||||
| WCL | 0.573385 | 0.973286 | 1.729205 | 0.162440 | 0.968804 | |||||
| TiL | 0.338330 | 0.949660 | 1.890634 | 0.135544 | 0.835203 | |||||
| TrL | 0.356295 | 0.901778 | 3.884842 | 0.011128 | 0.926265 | |||||
| MTo | 0.336751 | 0.954113 | 1.715328 | 0.168217 | 0.811821 | |||||
| ML | 0.606469 | 0.920192 | 5.463975 | 0.001269 | 0.553334 | |||||
| BeLN | 0.643786 | 0.866852 | 9.676731 | 0.000006 | 0.693650 | 0.348019 | 0.923222 | 2.966135 | 0.035313 | 0.804255 |
| BeW | 0.351257 | 0.914713 | 3.325544 | 0.022468 | 0.610851 | |||||
| ECL | 0.570946 | 0.977444 | 1.453799 | 0.228313 | 0.723657 | 0.342983 | 0.936777 | 2.407128 | 0.071247 | 0.724395 |
| Colorimétricos | ||||||||||
| Br | 0.578041 | 0.965446 | 2.254798 | 0.083427 | 0.047220 | 0.369821 | 0.868795 | 5.386365 | 0.001718 | 0.015068 |
| TP | 0.614376 | 0.908349 | 6.356613 | 0.000397 | 0.041578 | |||||
| BP | 0.583457 | 0.956485 | 2.866135 | 0.037901 | 0.061568 | |||||
| UBa | 0.363388 | 0.884177 | 4.672182 | 0.004160 | 0.013847 | |||||
| LBa | 0.342029 | 0.939391 | 2.301188 | 0.081344 | 0.263772 | |||||
| TB | 0.577590 | 0.966200 | 2.203901 | 0.089042 | 0.229196 | 0.337628 | 0.951637 | 1.812622 | 0.149245 | 0.271846 |
| RF | 0.582719 | 0.957696 | 2.782899 | 0.042224 | 0.042193 | |||||
| AB | 0.342430 | 0.938290 | 2.345755 | 0.076935 | 0.152853 | |||||
| LOCALIDAD TIPO | Lambda de Wilks | Lambda Parcial | Valor de F | Nivel de p | Tolerancia | Lambda de Wilks | Lambda Parcial | Valor de F | Nivel de p | Tolerancia |
| Sexo | Machos | Machos | Machos | Machos | Machos | Hembras | Hembras | Hembras | Hembras | Hembras |
| Morfométricos | ||||||||||
| WCL | 0.025883 | 0.694664 | 2.78378 | 0.068931 | 0.530441 | 0.382275 | 0.334862 | 10.92468 | 0.002436 | 0.723925 |
| MTo | ||||||||||
| ML | 0.040361 | 0.445476 | 7.88366 | 0.001287 | 0.758143 | 0.269878 | 0.474322 | 6.09549 | 0.016535 | 0.737667 |
| BeLN | 0.225576 | 0.567477 | 4.19202 | 0.044332 | 0.668581 | |||||
| ECL | 0.029498 | 0.609518 | 4.05738 | 0.021900 | 0.466975 | |||||
| Colorimétricos | ||||||||||
| Br | 0.058677 | 0.306422 | 14.33532 | 0.000040 | 0.419897 | |||||
| TP | ||||||||||
| BP | ||||||||||
| LBa | 0.023226 | 0.774134 | 1.84785 | 0.172771 | 0.682690 | |||||
| TB | 0.028537 | 0.630060 | 3.71862 | 0.029370 | 0.543687 | |||||
| RF | 0.027497 | 0.653885 | 3.35236 | 0.040712 | 0.410780 |
Cuadro 6 Coeficientes estandarizados para variables canónicas, resultado del análisis de función discriminante para datos morfométricos y colorimétricos de Callipepla californica, agrupaciones por sexo y categoría: Subespecie y Localidad tipo en la península de Baja California, México y California, EUA.
| Variable | SUBESPECIE | SUBESPECIE | LOCALIDAD TIPO | LOCALIDAD TIPO | Variable | SUBESPECIE | SUBESPECIE | LOCALIDAD TIPO | LOCALIDAD TIPO |
|---|---|---|---|---|---|---|---|---|---|
| MACHOS | HEMBRAS | ||||||||
| Raíz 1 | Raíz 2 | Raíz 1 | Raíz 2 | Raíz 1 | Raíz 2 | Raíz 1 | Raíz 2 | ||
| Morfométricos | Morfométricos | ||||||||
| WCL | 0.00766 | 0.04140 | -0.33603 | 0.923409 | WCL | -1.03529 | -0.139158 | ||
| TiL | TiL | 0.31803 | 0.069883 | ||||||
| TrL | TrL | -0.32563 | 0.143889 | ||||||
| MTo | MTo | 0.18152 | 0.288589 | ||||||
| ML | -0.60177 | -0.26165 | 0.82733 | 0.400929 | ML | 0.89800 | -0.444968 | ||
| BeLN | -0.73587 | 0.24029 | BeLN | 0.12213 | -0.520386 | -0.82183 | -0.771990 | ||
| BeW | BeW | 0.12192 | -0.456243 | ||||||
| BeD | BeD | ||||||||
| ECL | -0.29382 | -0.01484 | 0.84557 | 0.099794 | ECL | -0.25389 | -0.381194 | ||
| Colorimétricos | Colorimétricos | ||||||||
| Br | 1.11143 | 0.07388 | 1.25819 | -0.489606 | Br | 4.31388 | 0.872005 | ||
| TP | -1.96573 | 0.12661 | UBa | -4.22742 | 0.550827 | ||||
| BP | 0.54087 | -0.08466 | LBa | -0.25935 | 0.591549 | ||||
| UBa | TB | 0.28330 | -0.658928 | ||||||
| LBa | 0.58544 | -0.070385 | RF | ||||||
| TB | 0.00617 | 0.03738 | -0.67297 | -0.703541 | LF | ||||
| RF | 1.03293 | -0.09612 | -0.56670 | 0.620557 | AB | 0.63494 | -0.809418 | ||
| LF | |||||||||
| Valor propio | 0.53658 | 0.10406 | 19.25259 | 1.008723 | Valor propio | 0.83337 | 0.474144 | 5.90262 | 0.131735 |
| Prop. Acum. | 0.76997 | 0.91929 | 0.93330 | 0.982202 | Prop. Acum. | 0.57115 | 0.896101 | 0.97817 | 1.000000 |
En el diagrama de árbol generado por las distancias cuadráticas de Mahalanobis (D2) se distinguen dos subdivisiones, una integrada por las subespecies de la región central (C.c. decolorata) y sureña (C.c. achrustera) y la otra subdivisión conformada por las subespecies norteñas (C.c. plumbea y C.c. californica) (Figura 9A). En el diagrama de dispersión de los centroides de los especímenes de las subespecies comparadas (Figura 10A), no se distingue una separación clara entre ellas, existiendo un amplio traslape entre las subespecies C.c. achrustrera y C.c. decolorata, así como entre C.c. plumbea y C.c. californica.
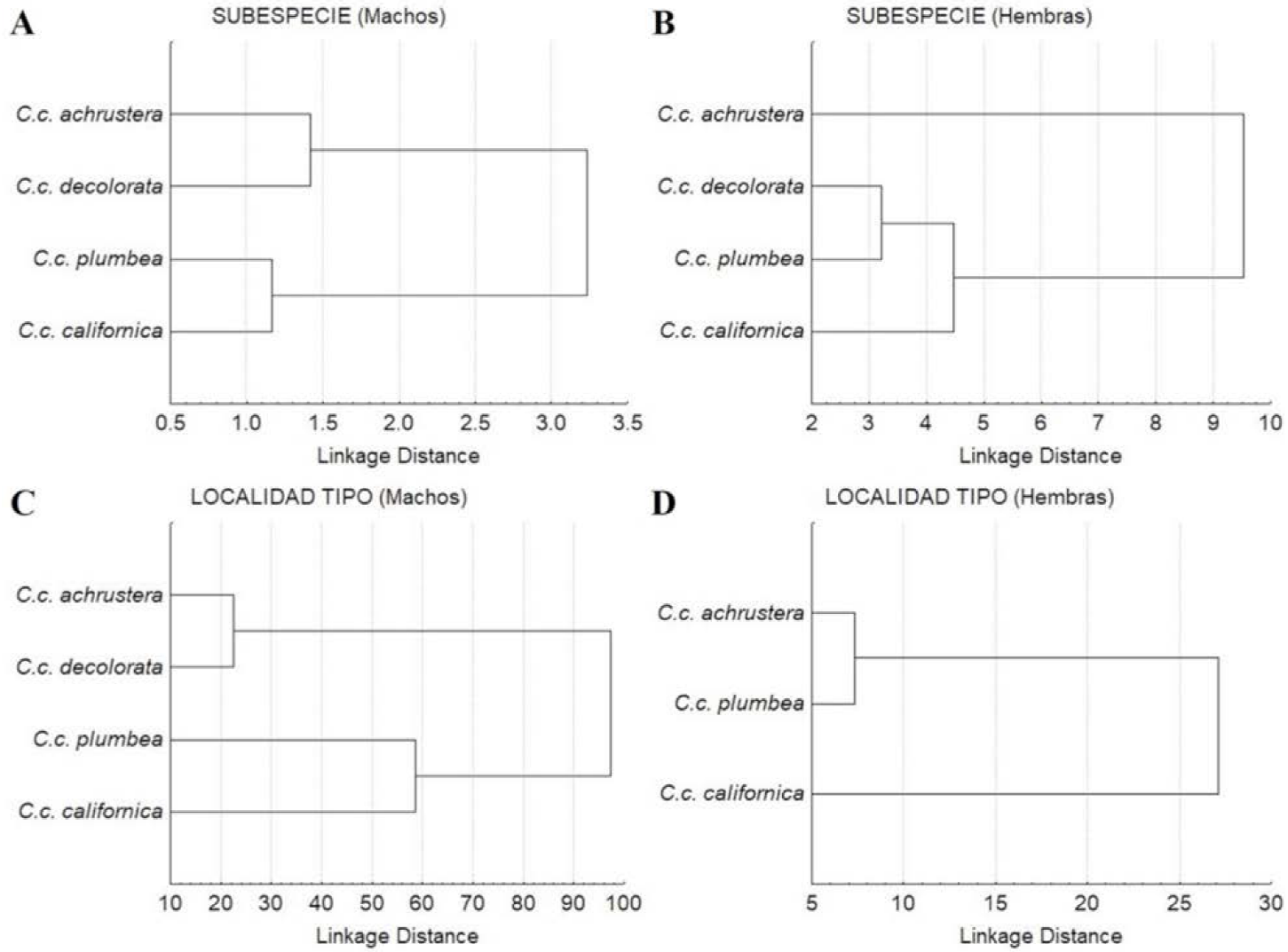
Figura 9 Dendrograma resultante de la Distancia cuadrática de Malahanobis para las poblaciones de Callipepla californica por sexos y categorías. A) Machos por subespecie, B) Hembras por subespecie, C) Machos por localidad tipo y D) Hembras por localidad tipo.
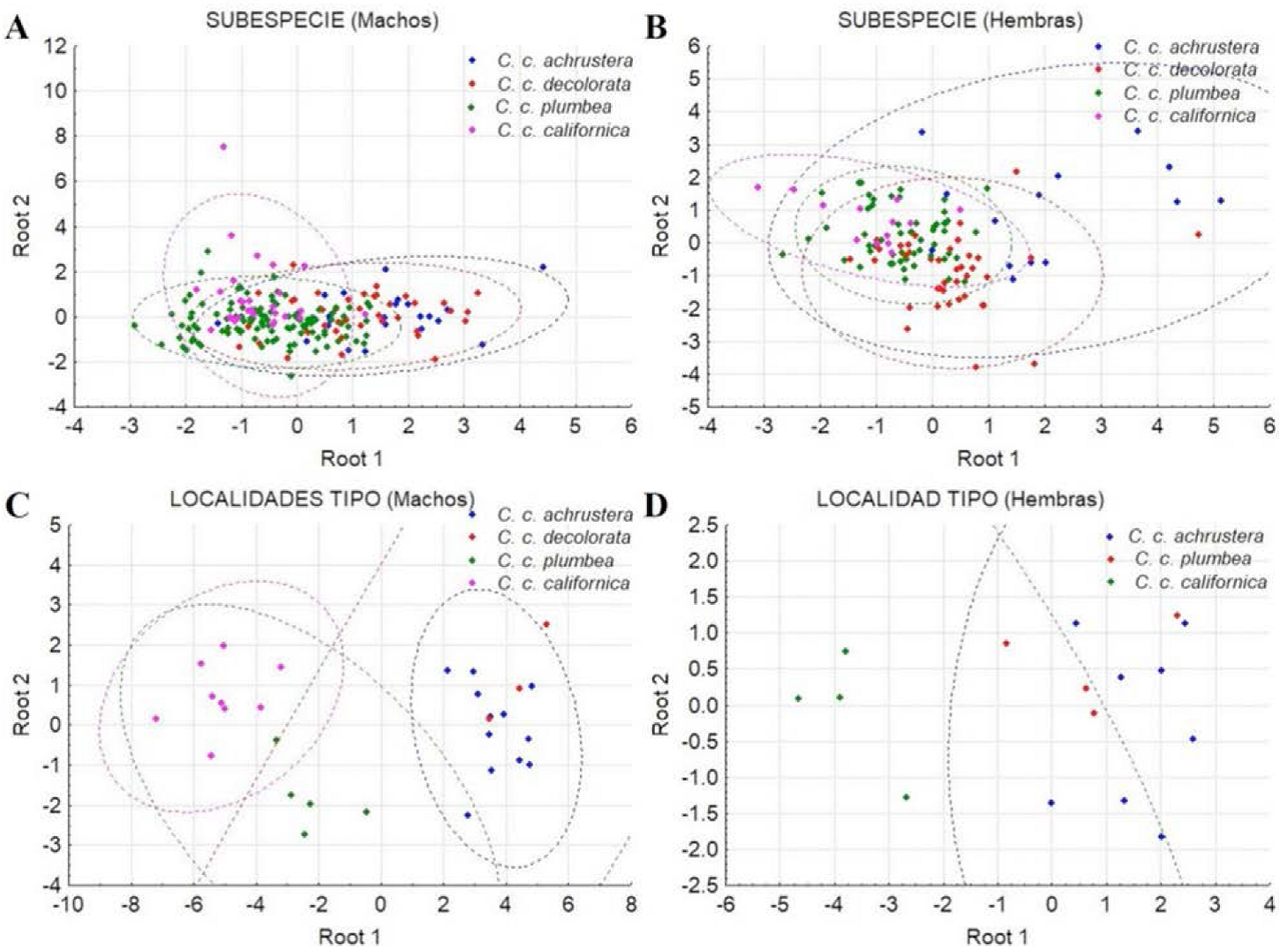
Figura 10 Diagrama de dispersión de centroides de las poblaciones de Callipepla californica analizadas por sexo y categoría. A) Machos por subespecie, B) Hembras por subespecie, C) Machos por localidad tipo y D) Hembras por localidad tipo.
En el caso de comparación de hembras entre subespecies, el AFD incluyó 115 individuos: 29 de C.c. achrustera, 20 de C.c. decolorata, 54 de C.c. plumbea, 12 de C.c. californica de localidades de California (EUA). Once variables fueron seleccionadas por el modelo que dio un valor global de Lambda de Wilks (λ) de 0.32 (P < 0.0001), el cual indica un mayor poder de discriminación entre las hembras de las distintas subespecies comparadas (Cuadro 5). Las variables independientes que mostraron un mayor valor significativo de discriminación (P < 0.01) entre las hembras de las subespecies fueron la luminosidad de la espalda alta (LBa, λ = 0.36) y del pecho (TP, λ = 0.37), longitud del tarso (TrL, λ = 0.35), longitud del dedo medio (MTo, λ = 0.33), ancho de pico (BeW, λ = 0.35) y longitud del pico desde la nostrila a la punta (BeLN, λ = 0.35) (Cuadro 5).
Los coeficientes estandarizados de las variables canónicas 1 y 2 obtenidas del análisis explicaron el 57% y 33% de la variación observada, respectivamente (Cuadro 6). El porcentaje de clasificación correcta general fue 69.4%, siendo de 43% para C.c. achrustera, 69% para C.c. decolorata, 87% para C.c. plumbea y 23% para C.c. californica. El dendrograma basado en las distancias cuadráticas de Mahalanobis (D2) demuestra la formación de dos subdivisiones, la primera formada por las subespecies C.c. decolorata, C.c. plumbea y C.c. californica, y la segunda contiene sólo a la subespecie sureña C.c. achrustera (Figura 9B). En el diagrama de dispersión de los centroides de los especímenes hembra de las diferentes subespecies, sólo es posible discriminar a las hembras de la subespecie más sureña C.c. achrustera del resto de las subespecies C.c. decolorata, C.c. plumbea y C.c. californica (Figura 10B).
Comparación de subespecies por localidades tipo
En el AFD para machos se analizaron 29 individuos pertenecientes a las localidades tipo de las subespecies C.c. achrustera (La Paz, BCS., n = 12), C.c. decolorata (Bahía Concepción BCS, n = 3), C.c. plumbea (San Quintín, BC, n = 5), y C.c. californica (Monterey, California, EUA, n = 9). Solamente siete variables fueron seleccionadas por el modelo de AFD (Cuadro 5), registrando un valor global de Lambda de Wilks (λ) de 0.02 (P < 0.0001), mismo que denota una excelente discriminación entre las poblaciones de localidades tipo comparadas. Los coeficientes estandarizados de las variables canónicas 1 y 2 explicaron de manera combinada el 98% de la variación observada (Cuadro 6). Cinco variables contribuyeron de manera significativa (P < 0.05) a la discriminación de machos entre las localidades tipo de las subespecies comparadas, dos de tipo morfométrico como la longitud del culmen expuesto (ECL, λ = 0.03) y la longitud de la mandíbula (ML, λ = 0.04) y tres de tipo colorimétrico como la luminosidad del pecho (Br, λ = 0.06), la luminosidad de la cola (TB, λ = 0.03) y la luminosidad del flanco derecho (RF, λ = 0.03) (Cuadro 5).
El porcentaje de clasificación correcta de los individuos machos por localidad tipo fue de 93.1%. De manera particular, el 100% de los individuos de C.c. achrustera fueron correctamente clasificados en la localidad tipo de La Paz, BCS, mientras que el 33% de los individuos de C.c. decolorata fueron correctamente clasificados en la localidad tipo de Bahía Concepción, BCS. Por su parte, el 100% de los individuos de C.c. plumbea fueron correctamente asignados a la localidad tipo de San Quintín, BC; y finalmente el 100% de individuos de C.c. californica fueron correctamente clasificados a la localidad tipo de Monterey, California, EUA.
El dendrograma de la Figura 9C basado en las distancias cuadráticas de Mahalanobis (D2) demuestra la presencia de dos grupos a un nivel de corte del 60% de distancia de enlace, el primero integrado por las subespecies C.c. achrustera y C.c. decolorata de las localidades más sureñas, La Paz, BCS y Bahía Concepción, BCS y el segundo representado por las subespecies C.c. plumbea y C.c. californica de las localidades tipo más septentrionales, San Quintín, BC y Monterey, California, EUA. El diagrama de dispersión de las variables canónicas 1 y 2 (Figura 10C) permitió observar dos grupos claramente definidos, uno formado por las localidades tipo de las subespecie C.c. achrustera (La Paz, BCS) y C.c. decolorata (Bahía Concepción, BCS) y el otro formado por las localidades tipo de las subespecies C.c. plumbea (San Quintín, BC) y C.c. californica (Monterey, California, EUA).
El AFD para hembras incluyó sólo a 16 individuos pertenecientes a las localidades tipo de las subespecies C.c. achrustera (La Paz, BCS n = 8), C.c. plumbea (San Quintín, BC n = 4) y C.c. californica (Monterey, California, EUA n = 4). No existieron registros de individuos hembra para la localidad tipo de la subespecie C.c. decolorata (Bahía Concepción, BCS). Tres variables fueron seleccionadas por el análisis discriminante (Cuadro 5). El valor global de Lambda de Wilks (λ) fue 0.13 (P < 0.0001) indicando un alto nivel de discriminación entre las poblaciones. Las variables morfométricas que resultaron ser significativas (p< 0.05) fueron la longitud de la cuerda del ala (WCL, λ = 0.38), la longitud del pico desde la nostrila a la punta (BeLN, λ = 0.23) y la longitud de la mandíbula (ML, λ = 0.27) (Cuadro 5). Los coeficientes estandarizados de la variable canónica 1 explicaron el 97.8% de la variación observada (Cuadro 6). De manera general, la clasificación correcta de los individuos hembras examinados fue 75%, siendo de 88% para C.c. achrustera en la localidad tipo de La Paz, 25% para C.c. plumbea en la localidad tipo de San Quintín, y 100% para C.c. californica en la localidad tipo de Monterey, California EUA.
En el dendrograma resultante de la distancia cuadrática de Mahalanobis (D2) se formaron dos ramificaciones, una por la subespecie C.c. californica de la localidad tipo más norteña (Monterey, California, EUA) y la otra conformada por las subespecies C.c. achrustera y C.c. plumbea de las localidades tipo de La Paz, BCS y San Quintín, BC, respectivamente (Figura 9D). Por su parte, el diagrama de dispersión (Figura 10D) de las variables canónicas 1 y 2 permitió distinguir a los individuos de la localidad tipo de la subespecie más septentrional C.c. californica (Monterey, California, EUA) de las localidades tipo peninsulares (San Quintín, BC y La Paz, BCS) de las subespecies C.c. plumbea y C.c. achrustera.
Caracteres diagnósticos para la identificación taxonómica obtenidos del AFD
Los caracteres morfológicos y colorimétricos que permitieron con el valor de Lambda de Wilks a una mayor discriminación entre las poblaciones de C. californica se encontró en la categoría de localidad tipo para ambos sexos (machos, λ = 0.02 y hembras, λ = 0.13).
Una mayor longitud de la mandíbula (Figura 11A) y del culmen expuesto (Figura 11B) entre subespecies fueron registrados en los machos de las localidades tipo de C.c. achrustera (La Paz, BCS) y C.c. decolorata (Bahía Concepción, BCS), respectivamente. Se observó un patrón descendente latitudinalmente del porcentaje de luminosidad del pecho (Figura 11C) y del flanco derecho (Figura 11E), donde los machos de las localidades tipo de las subespecies más sureñas C.c. achrustera (La Paz, BCS) y C.c. decolorata (Bahía Concepción, BCS) fueron más claros, que las subespecies más norteñas (Figuras 11C y 11E). No así para la luminosidad de la cola, donde el patrón latitudinal mostró que las subespecies más norteñas C.c. plumbea (San Quintín, BC) y C.c. californica (Monterey, California, EUA) tuvieron mayor luminosidad que sus contrapartes sureñas (Figura 11D).
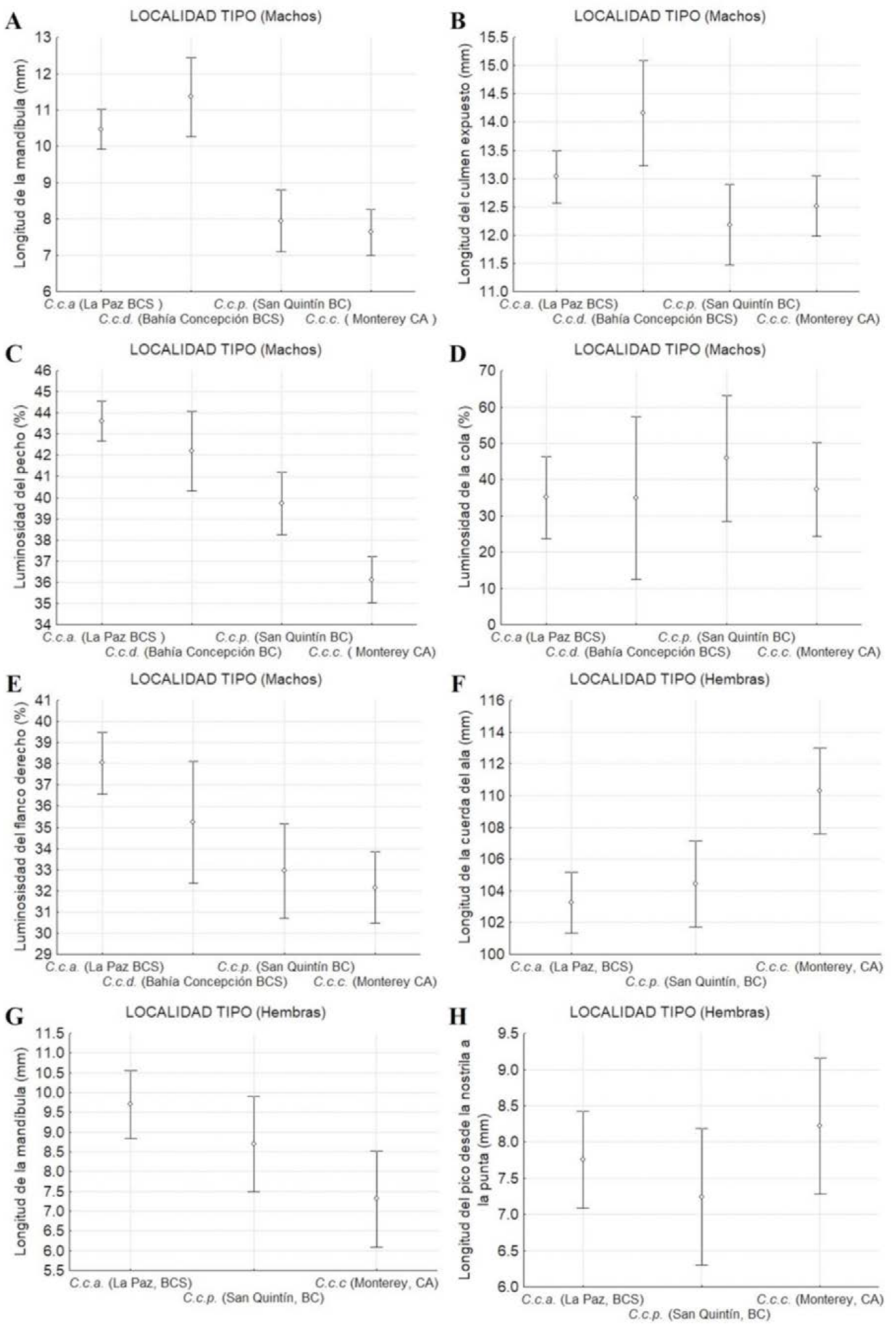
Figura 11 Medidas de dispersión y tendencia central (media ± IC) de los caracteres morfométricos y cromáticos que separaron mejor las poblaciones de las localidades tipo de las subespecies C.c. californica, C.c. plumbea, C.c. decolorata y C.c. achrustera para los machos (A, B, C, D y E) y para las hembras (F, G y H).
En las hembras, los resultados obtenidos mostraron que ninguna variable de color discriminó entre las localidades tipo de las subespecies. Los valores más altos de los caracteres morfométricos se observaron en las hembras de la localidad tipo de la subespecie C.c. californica (Monterey, California, EUA) y C.c. achrustera (La Paz, BCS). La mayor longitud del pico medido desde la nostrila a la punta (Figura 11 H) se registró en la localidad tipo de la subespecie más septentrional (C.c. californica), así como la longitud de la cuerda del ala (Figura 11 F). Sin embargo, la longitud de la mandíbula (Figura 11 G) presentó un patrón latitudinal descendiente, al igual que en los machos, donde las hembras de la localidad tipo de la subespecie más sureña, C.c. achrustera (La Paz, BCS) presentaron los valores más altos de longitud de la mandíbula.
Discusión
La mayoría de las especies de aves que se distribuyen en la península de Baja California exhiben diferenciación morfológica a nivel subespecífico (Grinnell 1928). Las subespecies peninsulares se han descrito principalmente al norte y sur del Vizcaíno, especialmente en la región del Cabo (Zink y Blackwell 1997, Vázquez-Miranda 2014). De forma general, si se considera a la subespecie como una unidad evolutiva discreta y significativa para la especie, resulta entonces necesario el estudio integrativo de la variación interpoblacional que pueda probar que las subespecies propuestas son unidades evolutivas significativas (Zink et al. 2016).
La presencia de variantes morfológicas de una especie a través de su distribución, ha sido durante mucho tiempo el principal criterio para la clasificación nominal a nivel subespecífico (cf.Baptista y Martínez-Gómez 2002, Zink et al. 2016). C. californica ha sido clasificada en siete subespecies nominales, cuatro de las cuales están presentes en la península de Baja California en un gradiente latitudinal que se ha diferenciado a través de su variación morfométrica y colorimétrica (Grinnell 1928, Van Rossem 1946, Leopold 1977). En aves, como en otros grupos, el concepto de subespecie ha generado polémica debido a que en numerosos casos las subespecies sólo representan ejemplos de variación geográfica, ya que no se cuenta con caracteres diagnósticos consistentes que permitan su discriminación adecuada. Muchas subespecies de aves fueron descritas empleando pocos especímenes de pocas localidades. Un ejemplo de esta problemática lo constituye la perlita californiana (Polioptila californica), catalogada como especie amenazada, donde el análisis filogeográfico, incluyendo datos morfológicos y ecológicos, no apoyaron la discriminación de la subespecie P.c. californica, la cual habita zonas de matorral costero en California y Baja California (Zink et al. 2000, Zink et al. 2013, 2016).
En aves de importancia cinegética, son muy escasos los trabajos que abordan esta problemática taxonómica, a pesar de la importancia que implica una identificación infraespecífica adecuada para su conservación. La diferenciación de las subespecies de la paloma blanca Zenaida asiatica, un ave de caza que habita en Texas, Arizona y Nuevo México, está basada principalmente en su variación morfológica (Pruett et al. 2000). Sin embargo al evaluar los caracteres morfométricos y genéticos de sus poblaciones, se encontró congruencia entre la variación de la región control y el tamaño corporal de las palomas, así como heterogeneidad geográfica de las áreas de distribución histórica de las cuatro subespecies reconocidas. Los resultados obtenidos apoyan el reconocimiento de sólo dos subespecies con una zona de intergradación entre ellas (Pruett et al. 2000).
Nuestro estudio, que implicó un análisis comparativo extensivo tanto morfométrico como colorimétrico para 338 especímenes examinados de cuatro subespecies nominales de C. californica de la península de Baja California, hizo evidente un nivel de discriminación relativamente bajo, lo cual indica que no hay una formación aparente de unidades poblacionales discretas que apoyen la identidad taxonómica de las subespecies nominales peninsulares.
Debido a que no fue posible definir unidades de comparación en el análisis de componentes principales (ACP) congruentes con las subespecies a priori, los resultados del análisis de función discriminante (AFD) deben tomarse con cautela. Si bien el AFD en la categoría de localidades tipo evidenció cuantitativamente la discriminación infraespecífica y los caracteres diagnósticos identificados son congruentes con las subespecies taxonómicas, también es necesario contar con un número mayor de datos de estas localidades, ya que los especímenes de éstas representaron sólo el 13.31% de la totalidad de los individuos analizados. Un análisis más robusto de las localidades tipo es necesario para corroborar los resultados obtenidos. La importancia de las localidades tipo radica en que estos sitios pueden presentar ciertas particularidades que permitan el mantenimiento de rasgos fenotípicos que han sido utilizados típicamente para la descripción taxonómica de subespecies y que podrían representar sólo adaptaciones locales.
En este sentido, los resultados obtenidos del ACP y AFD muestran diferenciación fenotípica para atributos relacionados con el tamaño del pico y coloración tanto en hembras como en machos. En aves, el tamaño del pico y el color del plumaje son caracteres asociados con patrones de la variación clinal y geográfica (Thorpe 1987). En Sitta carolinenies, el tamaño del pico muestra un patrón de variación clinal que permite distinguir poblaciones peninsulares de la Florida del resto de las poblaciones continentales (Wood 1992).
En C. californica existió un incremento del tamaño del pico en los especímenes colectados al extremo sur de la península en la región del Cabo (Figuras 11A, 11B, 11G y 11H), lo que nos indica que estos caracteres podrían estar relacionados a un patrón clinal al igual que las diferencias observadas en las variables de luminosidad del plumaje (Br, TP, BP, UBa, LBa, TB, RF, LF y AB). Siendo el patrón de coloración el principal criterio para la identificación de las subespecies en C. californica, existe la posibilidad de que todas sus subespecies, que se distribuyen desde Canadá hasta la provincia de Los Cabos en Baja California Sur, presenten la misma dificultad de identificación taxonómica observado en este estudio, donde las variaciones de coloración sean mejor explicadas por su ajuste a la regla geoclimática de Gloger, la cual indica que las plumas tienden a tener tonos más oscuros en hábitats donde la humedad relativa es más alta y tonos más claros donde la humedad relativa es más baja (Gloger 1883). Esta condición es debida a la proliferación de bacterias degradadoras del plumaje en hábitats con mayor porcentaje de humedad (Burtt e Ichida 2004). En este sentido, las diferencias observadas entre las siete subespecies descritas de C. califórnica podrían ser explicadas por este factor causal, ya que individuos provenientes de hábitats con mayor humedad como C.c. brunnecens (franja costera de California) y C.c. catalinensis (Isla Catalina) presentan una tonalidad más oscura, mientras que organismos de hábitats más áridos son más claros, como las subespecies C.c. canfieldae, C.c. decolorata y C c. achrustera, pudiendo existir individuos con tonalidades intermedias como C.c. californica y C.c. plumea.
Existieron diferencias en el nivel de discriminación por sexos en ambas categorías de subespecies y localidades tipo en el AFD. En especies con dimorfismo sexual, como la codorniz de California, el análisis por sexo resulta necesario para una interpretación adecuada de la información obtenida. Sin embargo, la presencia de diferencias en el nivel de discriminación relacionadas con el sexo, aporta nuevas interrogantes sobre aspectos de la biología, la ecología y la etología de la especie que pueden estar influyendo la permanencia o pérdida de caracteres involucrados en su identificación infraespecífica.
La diferencia en el nivel de discriminación entre sexos podría explicarse por el intercambio de individuos, principalmente machos vagabundos, durante la formación de la parvada y por el proceso de selección de pareja reproductiva. C. californica es una especie gregaria que presenta parvadas dinámicas en constante cambio, mismas que son mantenidas por el reclutamiento de nuevos individuos (Leopold 1977). El proceso dinámico de formación de la parvada donde existe reclutamiento de individuos foráneos, sugiere una posible discontinuidad de las características locales, debido al intercambio de aves entre parvadas. Por otra parte, las hembras tienden a aparearse con machos de su misma parvada. Sin embargo, se ha demostrado experimentalmente que las hembras de la codorniz de California presentan preferencias activas y flexibles en la selección de pareja para rasgos ya existentes en los machos, pero también para rasgos novedosos y combinados (Calkins y Burley 2003). Esta flexibilidad en el proceso de selección de pareja sugiere que los machos reclutados recientemente tienen la posibilidad de reproducirse en una nueva parvada, promoviendo así mayor aleatoriedad en la reproducción.
Los resultados obtenidos a través del AFD indican que los machos de la codorniz de California provenientes de las localidades tipo son fenotípicamente distinguibles entre las subespecies norteñas y sureñas. También es posible distinguir a las hembras de la localidad tipo de la subespecie más norteña (C.c. californica) por la longitud del pico y del ala, y a las hembras de la subespecie más sureña (C.c. achrustera) por la longitud de la mandíbula.
No se encontraron evidencias morfométricas ni colorimétricas que apoyen la existencia de cuatro subespecies nominales para la península de Baja California distribuidas latitudinalmente. Sin embargo, tampoco es posible descartar la existencia de al menos dos subespecies, ya que al igual que en un patrón de mosaico, los caracteres diagnósticos encontrados a través del AFD en las localidades tipo, pueden estar presentes de forma aleatoria en la península de Baja California. Dichos caracteres diagnósticos (variación del tamaño del pico y coloración) pueden estar distribuidos como parches o mosaicos, limitados por la capacidad de dispersión de la codorniz y por un proceso de reproducción aleatorio. La variación morfológica en mosaico se refiere a áreas geográficas habitadas por poblaciones distintivas que se distribuyen al azar a través del intervalo de la especie (Thorpe 1987). Por otra parte, se desconoce la estructura genética de las poblaciones peninsulares de esta codorniz, por lo que no es posible descartar flujo genético restringido, debido al aislamiento por distancia geográfica. Cabe mencionar que el trabajo genético de la especie realizado por Zink et al. (1987), sólo incluyó tres sitios de muestreo en la península y se llevó a cabo usando aloenzimas como marcador molecular. El uso de aloenzimas para este tipo de estudios presenta problemas relacionados con la sobreestimación de la variabilidad genética por modificaciones postraduccionales de las proteínas y con la subestimación porque las secuencias de aminoácidos no reflejan la variabilidad de los codones, debido a la degeneración del código genético. Por tanto, es necesario realizar un estudio de variabilidad genética con marcadores moleculares adecuados para las poblaciones peninsulares.
Se sugiere considerar, en trabajos de poblaciones con aves terrestres, un muestreo adecuado de las localidades tipo de las subespecies. Ya que las localidades tipo podrían tener información biológica y ecológica sobre las poblaciones relacionada con la conservación o pérdida de caracteres fenotípicos característicos de las subespecies. Es recomendable que instituciones como Semarnat y Conabio promuevan estudios sobre la biología y ecología de la codorniz de California, debido a que se desconoce el estatus actual de sus poblaciones en la península de Baja California. A pesar de ser una especie con manejo cinegético en la región, no se cuenta con información ecológica local. Por otra parte, las recomendaciones para su manejo y conservación provienen de una gran cantidad de estudios realizados hace ya varias décadas en poblaciones de California, por lo que es apremiante contar con información adecuada para su manejo y conservación.
La comparación fenotípica de las poblaciones peninsulares de C. californica para determinar caracteres diagnósticos para la identificación taxonómica infraespecífica reveló un posible patrón de variación geográfica en mosaico que obstaculiza la identificación taxonómica a nivel de subespecie, por lo que es recomendable que para asignar un individuo a una subespecie no sólo se considere la distribución latitudinal del mismo, sino que se ponga especial atención a la diferenciación en la tonalidad del plumaje y el tamaño del pico, así como de las características ambientales del sitio como temperatura y humedad para identificar posibles variaciones debidas a las condiciones micro climáticas. De otra forma no es recomendable la identificación taxonómica infraespecífica para esta especie en la península de Baja California.











 nueva página del texto (beta)
nueva página del texto (beta)


