Introducción
El frijol (Phaseolus vulgaris L.) es conocido como una de las principales fuentes de nutrientes en todo el mundo, ocupando un lugar importante en la dieta humana, debido al contenido de proteínas, carbohidratos, minerales y vitaminas (Diaz et al., 2010; Celmeli et al., 2018). Además, tiene compuestos fenólicos como ácido ferúlico, p-cumárico y gálico, así como gran variedad de flavonoides como son antocianinas, flavonoles y proantocianidinas, los cuales le confieren actividad biológica antioxidante. Los antioxidantes se relacionan con la disminución de enfermedades crónicas, ya que pueden contrarrestar las especies reactivas de oxígeno, inhibiendo los mecanismos oxidativos que conducen a la degeneración celular, confiriendo con esto grandes efectos benéficos a la salud (Mojica et al., 2014). Lo anterior, depende de la cantidad consumida de los compuestos fenólicos, de su bioaccesibilidad (fracción máxima liberada de la matriz del alimento) y su biodisponibilidad (fracción que alcanza la circulación para ejercer acción en el organismo) (Manach et al., 2004; Gutiérrez-Grijalva et al., 2016), el cual implica un proceso complejo de varias etapas diferentes: fases de liberación, absorción, distribución, metabolismo y eliminación (Maarit et al., 2013).
Los compuestos fenólicos, son compuestos naturales, de grupos fenilo hidroxilados, que se encuentran en formas glucosiladas, esterificados o polimerizados. Cuando son ingeridos, son reconocidos por el cuerpo humano como xenobióticos. Los polifenoles de bajo peso molecular tales como estructuras monoméricas y diméricas, pueden ser absorbidos por el intestino delgado (Karas et al., 2016). Se han llevado a cabo estudios, en los cuales afirman que el 5-10% de la ingesta total se absorbe en el intestino delgado. El resto se acumula en el gran lumen intestinal, los cuales son excretados a través de la bilis y/o sometidos a las actividades enzimáticas de la comunidad microbiana intestinal (Cardona, 2013; Perez-Perez et al., 2018). Por lo tanto, los compuestos fenólicos podrían ser sensibles a condiciones de digestión y modificados en favorables estructuras promotoras de salud (Kahlon y Smith, 2007). Así mismo, los antioxidantes naturales pueden funcionar sinérgicamente para promover la salud humana, sin embargo, investigaciones sobre el efecto de la digestión gastrointestinal de los antioxidantes son escasos. Se han realizado algunos reportes de biodisponibilidad que señalan que los polifenoles pueden depender de su absorción en el intestino (Saura-Calixo et al., 2006). Así mismo, Laparra et al. (2008) evaluaron la bioaccesibilidad individual de polifenoles en frijol, exhibiendo valores altos de bioaccesibilidad. Soriano et al. (2015) reportaron una disminución de compuestos bioactivos y un aumento en la actividad antioxidante por efecto de la digestión in vitro en testa de frijol. Además, la bioaccesibilidad de los antioxidantes en la dieta es importante porque en la digestión gastrointestinal deben estar disponibles para su absorción, y así ayudar a proteger al intestino contra especies reactivas de oxígeno (Chia-Jung et al., 2013), así como a proteger la mucosa intestinal a través de actividades antioxidantes y antiinflamatorias (Gálvez et al, 2001).
Por todo lo anterior, el objetivo de este trabajo fue determinar la bioaccesibilidad de compuestos antioxidantes de diferentes variedades de frijol (Phaseolus vulgaris L.) producidos en México, mediante un sistema gastrointestinal in vitro.
Materiales Y Metódos
Material Vegetal
Se utilizaron seis variedades de frijol en grano, representativos de Chihuahua (frijol Pinto Saltillo), Durango (frijol Flor de Mayo y frijol Patol), Morelos (Frijol Negro), Jalisco (Peruano) y Tabasco (frijol Teapa), en base a la preferencia de consumo (Figura 1). Las muestras se trasladaron al laboratorio en donde se procedió a realizar la extracción de los compuestos antioxidantes.
Extracción de los compuestos antioxidantes
Los granos crudos de cada tipo de frijol se molieron y tamizaron (tamiz número 20) hasta obtener un tamaño de partícula de 0.84 mm. Posteriormente, 15 g de muestra se mezclaron con 30 mL de metanol al 80%, se agitó por una hora en un skhaker orbital KJ-201 BD para después ser centrifugados por 10 min a 4000 x g a 4 °C. Se recuperaron los sobrenadantes y al residuo se volvió a aplicar por segunda ocasión el mismo procedimiento de extracción. Al final los dos sobrenadantes obtenidos se combinaron y se concentraron a presión reducida mediante rotavapor (Buchi, R-100 V ) para la determinación del rendimiento de extracto obtenido. Posteriormente se resuspendieron en metanol hasta obtener una concentración de 0.178 g de extracto/mL. Las muestras se almacenaron a -20 oC para su posterior análisis. Adicionalmente, se utilizaron muestras cocidas para el estudio. Para el cocimiento, los granos de frijol (80 g) se remojaron durante 10 h en agua destilada (100 mL), para posteriormente ser cocinados en una autoclave a 121 °C durante 30 min (modificado de Luo et al., 2014). Una vez cocidos, se molieron y se extrajeron los compuestos siguiendo el mismo procedimiento que en las muestras crudas, donde también se calculó el rendimiento de extracto para cada muestra cocida. Posteriormente se resuspendieron en metanol hasta obtener una concentración de 0.178 g de extracto/mL. Las muestras se almacenaron a -20 oC para su posterior análisis.
Determinación de Fenoles totales
Se realizó de acuerdo a la técnica de Folin Ciocalteu (Eldeen et al., 2011). Se tomaron 10 μL de extracto y se agregaron 25 μL de solución de Folin 1 N. Se dejó reposar por 5 min a temperatura ambiente. Posteriormente se adicionaron 25 μL de Na2CO3 al 20 % y 140 μL de agua destilada para llegar a un volumen final de 200 μL. Se dejó reposar 30 min y se determinó la absorbancia a 760 nm. Se realizó una curva de calibración entre 0 y 1 mg/mL con el estándar ácido gálico, la calibración fue medida por triplicado. Los resultados se expresaron como miligramos de equivalentes de ácido gálico por gramo de muestra (mg EAG/g). Todas las mediciones se realizaron por triplicado.
Determinación de Flavonoides
Los flavonoides totales se realizaron por el método colorimétrico basado en Venu et al. (2012). Se tomaron 80 μL de extracto y fueron adicionadas a 80 μL de una solución etanólica de tricloruro de aluminio (20 g/L). Se agitaron por 30 s y se cubrieron con parafilm. Se dejaron reposar durante 1 h en oscuridad a temperatura ambiente. Posteriormente se volvieron a agitar durante 30 s y se midió la absorbancia a 415 nm. Se realizó una curva de calibración entre 0 y 0.8 mg/mL con el estándar querencitina, la calibración fue medida por triplicado. Los resultados se expresaron como miligramos de equivalentes de quercetina por gramo de muestra (mg EQ/g).
Capacidad antioxidante por ABTS (ácido 2,2′-azi-no-bis-(3 etilbenzotiazolin-6-sulfónico))
La preparación del radical se realizó según la metodología de Re et al. (1999). Para la preparación del radical, se tomaron 19.3 mg de ABTS y se disolvieron en 5 mL de agua destilada, por separado se pesaron 0.0378g de persulfato de potasio y se mezclaron con 1 mL agua. Posteriormente se tomaron 88 µL de la solución de persulfato y se agregaron a la solución de ABTS dejándose en oscuridad por 12 horas. De esta última solución se preparó una solución ajustada a una absorbancia de 0.7 ± 0.01 a una longitud de onda de 734 nm. Se tomaron 270 µL de la solución del radical catiónico preparado y se adicionaron 20 µL de muestra leyendo a una absorbancia de 734 nm después de 30 min de reposo. Se realizó una curva de calibración entre 0 y 1 mg/mL con Trolox (Ácido-6-hidroxi- 2,5,7,8-tetrametilcroman-2-carboxílico), la calibración fue medida por triplicado. Los resultados se expresaron en µM de equivalentes Trolox por gramo de muestra (µM ET/g). Adicionalmente, se calculó la IC50 (Concentración inhibitoria media) a través de una serie de diferentes concentraciones (0, 25, 50, 75, 100, 125,150, 175 y 200 µg/mL) calculando el porcentaje de inhibición de acuerdo a la siguiente ecuación:
Capacidad antioxidante por DPPH (2,2-Difenil-1-Picrilhi-drazilo)
Se pesaron 1.5 mg de radical DPPH• y se disolvieron en 50 mL de metanol de los cuales se ajustó a una absorbancia de 0.7 ± 0.01 en una longitud de onda de 515 nm (Molyneux, 2004). De esta mezcla se tomaron 200 µL de radical con 20 µL de muestra. Se dejó reposar 30 min en oscuridad y se midió a una longitud de onda de 515 nm. Se realizó una curva estándar con trolox desde 0 a 200 µM. Los resultados se expresaron en µM de equivalentes Trolox por gramo de muestra (µM ET/g). Adicionalmente, se calculó la IC50 (Concentración inhibitoria media) de la misma forma que con el radical ABTS●+.
Poder antioxidante reductor férrico (FRAP- Ferric reducing antioxidant power)
El poder antioxidante por reducción del ión férrico a ferroso, se determinó utilizando la metodología de Rubio et al. (2016) con modificaciones. Primero se preparó una solución stock, la cual se realizó en condiciones ácidas (pH 3.6), que incluye una solución de buffer de acetato de sodio (300 mmol/L a un pH de 3.6). Posteriormente se preparó el complejo de hierro-TPTZ con 20 mmol de FeCl3·6H2O en una solución de TPTZ (2,4,6-tripiridil-s-triazin) en 40 mmol de HCl. Una vez preparadas las soluciones Stock, se procedió a preparar la solución de trabajo (solución de FRAP). Donde, se agregaron las soluciones a una relación de 10:1:1 (Buffer: FeCl3·6H2O: TPTZ·HCl). Un volumen de 20 µL de muestra se agregó a 280 µL de la solución de FRAP, se tomaron lecturas a los 30 min en un lector de microplaca de 96 pocillos (Thermo Fisher Scientific Inc. Multiskan GO, NY, USA) a 638 nm. La reducción del ión férrico ocurre visualmente en un cambio de color, desde transparente a azul. Se realizó una curva estándar con trolox, con concentraciones que van desde 0 a 200 µM. Los resultados se expresaron como µM ET/g de muestra.
Sistema gastrointestinal in vitro
La determinación de la digestibilidad y bioaccesibilidad para los extractos de cada muestra de frijol, se realizó a través de un modelo gastrointestinal in vitro de acuerdo con la metodología usada por Van-Campen y Glahn (1999) y Tarko et al. (2009). Consistió en la exposición de la harina de frijol cocida a enzimas digestivas: pepsina y pancreatina, evaluando el contenido de compuestos fenólicos, flavonoides y capacidad antioxidante. Se seleccionó a un voluntario aparentemente sano, el cual se lavó los dientes con pasta dental y el último bocado que probó fue a 90 min antes de la prueba. Se dieron 15 g de harina de frijol cocido a masticar 15 veces durante 15 segundos. Se homogenizó con 10 mL de agua purificada. Posteriormente se acidificaron las muestras con HCl 6M hasta llegar a un pH de 2. Se adicionaron 22.5 mL de pepsina (315 U/mL) (Sigma, P7012-5G) y 22.5 mL de agua destilada. La muestra se colocó en un shaker con baño maría (modelo) a 80 rpm a 37 ºC durante 2 horas. Una vez transcurrido este tiempo se neutralizaron las muestras (pH 7) con NaHCO3 1.25 M y se agregaron 5.625 mL de pancreatina (4 mg/mL) (Sigma, P1750-100G) a cada matraz. Se homogenizó bien y las muestras se colocaron dentro de baño María con shaker a 80 rpm durante 4 horas a una temperatura de 37 ºC. Posteriormente se realizaron las mediciones correspondientes (fenoles, flavonoides y capacidad antioxidante).
Análisis estadístico
Se realizó estadística descriptiva, análisis de varianza unifactorial con comparaciones múltiples de Tukey a un nivel de significancia de 5% (p<0.05), utilizando el paquete estadístico Infostat (versión 2008). Los resultados se expresaron como medias ± desviación estándar de tres determinaciones.
Resultados Y Discusion
Rendimiento de los extractos
El rendimiento de los extractos crudo y cocido obtenidos de cada una de las muestras de frijol se observan en la (Tabla 1). La variedad Pinto Santillo, obtuvo el mayor rendimiento del extracto de frijol crudo. Así como, un decremento en el rendimiento del extracto cocido en las variedades de frijol negro, Flor de Mayo y Pinto Saltillo. Sin embargo, las variedades de frijol Teapa y Peruano incrementaron 3.4 y 1.57 veces respectivamente respecto al crudo, mientras que el frijol Patol prácticamente no se vio afectado.
Tabla 1 Rendimiento de extractos obtenidos de muestras de frijol antes y
después del cocimiento.
Table 1. Extract yields obtained from bean samples before
and after cooking.
| Muestra frijol | Peso inicial (g) | Peso de extracto (g) | Rendimiento | |
|---|---|---|---|---|
| g extracto/g muestra | % | |||
| Crudo | ||||
| Negro | 15.04 ± 0.01 | 1.92 ± 0.22 | 0.13 ± 0.011b | 13± 1.1b |
| Flor de mayo | 15.02 ± 0.02 | 1.86 ± 0.14 | 0.12 ± 0.003b | 12± 0.3b |
| Patol | 15.07 ± 0.01 | 1.15 ± 0.31 | 0.08 ± 0.001c | 8± 0.1c |
| Pinto Saltillo | 15.05 ± 0.01 | 3.69 ± 0.28 | 0.25 ± 0.013a | 25 ± 1.3a |
| Teapa | 15.07 ± 0.02 | 0.78 ± 0.03 | 0.05 ± 0.002d | 5 ± 0.2d |
| Peruano | 15.05 ± 0.03 | 1.10 ±0.09 | 0.07 ± 0.003c | 7± 0.3c |
| Cocido | ||||
| Negro | 15.17 ± 0.10 | 0.53 ± 0.01 | 0.03 ± 0.001d | 3 ± 0.1d |
| Flor de mayo | 15.03 ± 0.01 | 1.54 ± 0.25 | 0.10 ± 0.001b | 10 ± 0.1 b |
| Patol | 15.22 ± 0.15 | 1.49 ± 0.08 | 0.09 ± 0.002bc | 9 ± 0.2bc |
| Pinto Saltillo | 15.52 ± 0.34 | 1.08 ± 0.12 | 0.07 ± 0.001c | 7± 0.1c |
| Teapa | 15.09 ± 0.03 | 2.59 ± 0.09 | 0.17 ± 0.031a | 17 ± 3.1a |
| Peruano | 15.15 ± 0.11 | 1.66 ± 0.05 | 0.11 ± 0.022b | 11± 2.2b |
Media ± Desviación estándar /Mean ± standard deviation. Letras diferentes en la misma columna indica diferencia estadística significativa (p < 0.05) para cada tratamiento.
Al respecto, distintos autores como Madhujith y Shahidi (2005), han reportado trabajos de frijol crudo, donde el frijol negro presentó el mayor rendimiento de extracto (0.206 g de extracto/g), frijol rojo (0.167 g de extracto/g), frijol blanco (0.141 g de extracto/g) y frijol marrón (0.171 g de extracto/g). Si se compara con nuestro estudio, el rendimiento de frijol negro es menor, esta diferencia puede deberse al tipo de solvente utilizado, ya que en nuestro estudio se utilizó metanol al 80% para la extracción y en el de los otros autores fueron extraídos con acetona al 80%. Por lo tanto, resulta complicado comparar rendimientos de extractos de los diferentes estudios en frijol por todas las variaciones implícitas en los procesos de extracción. Por otra parte, se puede observar que existen diferencias en los rendimientos de extracto entre las distintas variedades. Es probable que estas diferencias se deban a los tipos de compuestos que conforman a los extractos, ya que cada variedad de frijol puede verse afectada en su composición por varios factores como al genotipo, altitud, temperatura, humedad y suelo de su lugar de procedencia (Aleum, 2017).
Uno de los beneficios del cocimiento del frijol es la de mejorar sus propiedades físicas y organolépticas, además, de que incrementa el uso biológico de las proteínas, debido a que se destruyen ciertos factores termolábiles como son los inhibidores de funciones metabólicas, tripsina, hemaglutinina y otros inhibidores enzimáticos (García, 2014). De ahí la importancia de consumir el frijol cocido y de analizarlo también de esta forma en nuestro estudio. Sin embargo, el efecto del cocimiento se ve reflejado en algunas de las muestras decreciendo o bien aumentando su rendimiento. Se sabe que el cocimiento puede llegar a degradar los compuestos influyendo en el rendimiento final. Por otra parte, puede haber una transformación de ellos y/o formación de nuevos compuestos ya que la temperatura afecta a las estructuras formando nuevas moléculas, lo cual podría explicar el incremento en los rendimientos del frijol Teapa y Peruano.
Contenido Fenólico
Se determinó el contenido de fenoles en las diferentes variedades de frijol antes y después del cocimiento (Figura 2). Los valores obtenidos en nuestro estudio oscilan entre 1.91 a 5.66 mg EAG/g en frijol crudo y valores de 0.68 a 3.47 mg EAG/g en frijol cocido. Las variedades de frijol Teapa y Peruano son las que presentaron mayor cantidad de fenoles totales antes del cocimiento. Sin embargo, después del cocinado disminuyen más de la mitad. Las variedades Flor de Mayo y Patol son las que conservan la mayor cantidad de compuestos fenólicos después de haberlos sometido a cocimiento.
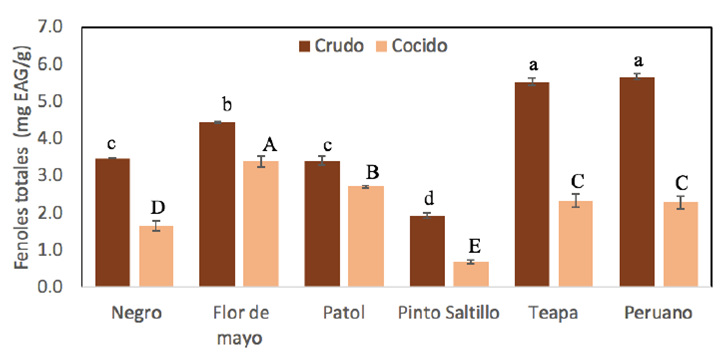
Figura 2 Cuantificación de fenoles totales de las diferentes muestras de
frijol antes y después del cocimiento. Letras diferentes indican
diferencia estadística significativa (p < 0.05).
Letras minúsculas se comparan entre los tipos de frijol crudo y
letras mayúsculas entre los tipos de frijol cocido.
Figure 2. Total phenols quantification of the different
bean samples before and after cooking. Different letters indicate
statistically significant difference (p < 0.05).
Algunas investigaciones han mencionado la relación del color del frijol con el contenido de compuestos fenólicos, en donde los frijoles con color claro contienen menor cantidad de fenoles en comparación a los frijoles oscuros (Xu et al., 2009). Sin embargo, en el presente estudio el frijol peruano con pigmentación amarilla presentó el valor más alto en fenólicos a diferencia del frijol negro. Así mismo, autores como Rocha-Guzmán et al. (2007) han encontrado que el frijol cocido disminuye de 73 a 90 % la cantidad de contenido fenólico por efecto de lixiviación, en donde a mayor temperatura mayor lixiviación. Huber et al. (2016) mencionan que el cocimiento aumenta la concentración del contenido fenólico. La Farga et al. (2019) argumenta que el aumento se debe a una mayor extracción causado por la ruptura celular durante la cocción. Estas diferencias pueden atribuirse al procesamiento térmico, remojo, condiciones de almacenamiento, ambientales y genotipos.
Flavonoides
Se determinó el contenido de flavonoides en las diferentes variedades de frijol antes y después del cocimiento (Figura 3). Los valores obtenidos en nuestro estudio oscilan entre 0.83 a 3.31 mg EQ/g en frijol crudo y valores de 0.21 a 3.70 mg EQ/g en frijol cocido, cantidades más bajas a los fenoles debido a que son un subgrupo de compuestos fenólicos. Sin embargo, las variedades de frijol crudo Flor de Mayo y Patol presentaron la mayor cantidad de flavonoides, pero también son los que presentan mayor disminución de los mismos después del cocimiento. En cambio, las variedades Teapa, Peruano y Pinto Saltillo, mostraron un incremento de flavonoides después del cocinado. Huber et al. (2016) menciona que cuando el frijol se somete a cocimiento se presenta un aumento de flavonoides. Contrariamente, Xu et al. (2009), reportan que remojar y cocinar el frijol ejerce un efecto negativo en las concentraciones de flavonoides. Por lo que en nuestro estudio el procesamiento de cocción causó ambos efectos en las distintas variedades de frijol.
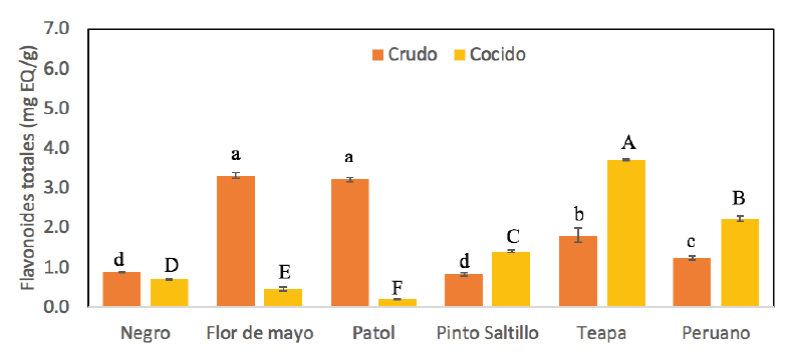
Figura 3 Cuantificación de flavonoides totales de las diferentes muestras de frijol antes y
después del cocimiento. Letras diferentes indican diferencia
estadística significativa (p < 0.05).
Figure 3. Total flavonoids quantification of the
different bean samples before and after cooking. Different letters
indicate statistically significant difference (p < 0.05).
Capacidad Antioxidante
Los resultados obtenidos en capacidad antioxidante por DPPH, ABTS y FRAP en las diferentes variedades de frijol antes y después del cocimiento se pueden observar en la Figura 4. Los valores obtenidos en nuestro estudio oscilan entre 0.60 a 3.01 µM ET/g en frijol crudo y valores de 0.58 a 2.90 µM ET/g en frijol cocido en DPPH; 0.68 a 2.18 µM ET/g en frijol crudo y valores de 0.52 a 1.94 µM ET/g en frijol cocido en ABTS; y 5.24 a 36.99 µM ET/g en frijol crudo y valores de 5.22 a 17.80 mg EAG/g en frijol cocido en FRAP. La cocción incrementó la actividad antioxidante del radical DPPH en las variedades de frijol Negro y Patol. Sin embargo, disminuyó en las variedades de Flor de Mayo y Pinto Saltillo. En Teapa se mantuvo estable. En ABTS las variedades de Negro, Flor de Mayo, Teapa y Peruano observaron un incremento de la actividad antioxidante después del cocimiento, mientras que en Patol y Pinto Saltillo decreció. Para FRAP casi todos estuvieron estables con ligero aumento en Negro y Peruano, y ligera disminución en Flor de mayo, Patol y Pinto Saltillo. Solo la variedad Teapa presentó una disminución considerable del 52 % después del cocimiento.

Figura 4 Capacidad antioxidante por DPPH (a), ABTS (b) Y FRAP (c) de las diferentes muestras de
frijol antes y después del cocimiento. Letras diferentes indican
diferencia estadística significativa (p < 0.05).
Figure 4. Antioxidant capacity by DPPH (a), ABTS (b)
and FRAP (c) of the different bean samples before and after cooking.
Different letters indicate statistically significant difference (p
< 0.05).
La combinación de estos ensayos proporcionó una mayor evaluación de las actividades antioxidantes de las muestras de frijol antes y después del cocimiento. Además, autores como Xu y Chang (2009), Gálvez et al. (2009), Rocha-Guzmán et al. (2009) y Huber et al. (2016) evaluaron la capacidad antioxidante de variedades de frijol Negro, Pinto Satillo, Flor de Mayo, antes y después de cocción en remojo y sin remojo y presentan comportamientos similares a los obtenidos en este estudio. Botaeng et al. (2007) menciona que la cocción y retención de los componentes bioactivos después del cocimiento, presenta cantidades adecuadas de antioxidantes para una dieta saludable. Sin embargo, la forma de preparación de los alimentos puede ser tan importante como el alimento en sí. Por lo tanto, aún con la disminución de bioactivos después de la cocción existe actividad antioxidante, por lo que una dieta rica en leguminosas podría beneficiar a la salud humana.
En la Figura 5 se observa la cinética de inhibición al radical DPPH para determinar la concentración inhibitoria media (IC50) de los extractos de frijol, en donde las variedades Teapa con 106.45 µg/mL y Flor de Mayo con 127.16 µg/mL, fueron las que alcanzaron el 50 % de inhibición en las concentraciones estudiadas. En ABTS (Figura 5), las variedades de Teapa con 176.21 µg/mL y Pinto Saltillo 154.72 µg/mL, fueron las muestras que lograron alcanzar la IC50 en este radical. La composición de los extractos juega un papel importante para poseer capacidad antioxidante. Generalmente con el método de extracción que se utilizó en este estudio, se obtienen compuestos fenólicos. De todos los compuestos fenolicos, el grupo de los flavonoides es el más extendido en la naturaleza y dentro de ellos, los flavonoles son los que poseen un mayor potencial antioxidante (Perez-Perez et al., 2018). Sin embargo, para poder explicar si estos compuestos confieren realmente la mayor capacidad antioxidante, se realizaron correlaciones (Tabla 2).

Figura 5 Cinéticas de inhibición del radical DPPH para la determinación de las concentraciones
inhibitorias medias (IC50) de los extractos de frijol.
Figure 5. Inhibition kinetics of DPPH radical to
determine the medium inhibitory concentrations (IC50)
from bean extracts.
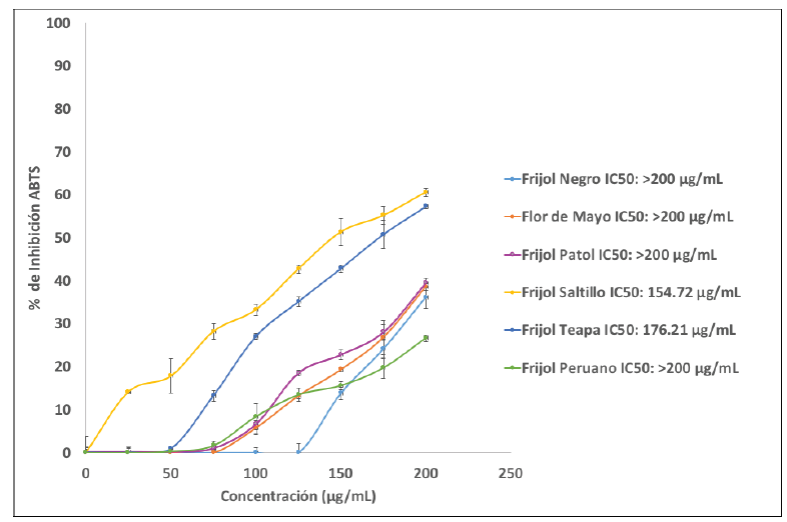
Figura 6 Cinéticas de inhibición del radical ABTS para la determinación de las concentraciones
inhibitorias medias (IC50) de los extractos de frijol.
Figure 6. Inhibition kinetics of ABTS radical to
determine the medium inhibitory concentrations (IC50)
from bean extracts.
Tabla 2 Correlaciones (R2) de la capacidad antioxidante contra los fenoles y flavonoides de
los extractos de frijol.
Table 2. Correlations (R2) of the antioxidant capacity
versus phenols and flavonoids of bean extracts.
| Correlaciones (R2) | ||
|---|---|---|
| Fenoles | Flavonoides | |
| Frijol Negro | ||
| DPPH | 0.4541 | 0.5749 |
| ABTS | 0.6131 | 0.7617 |
| FRAP | 0.9922 | 0.982 |
| Fenoles | - | 0.9686 |
| Frijol Flor de Mayo | ||
| DPPH | 0.9917 | 0.9872 |
| ABTS | 0.6676 | 0.6784 |
| FRAP | 0.996 | 0.9987 |
| Fenoles | - | 0.9978 |
| Frijol Patol | ||
| DPPH | 0.5829 | 0.6433 |
| ABTS | 0.8874 | 0.8874 |
| FRAP | 1 | 1 |
| Fenoles | - | 1 |
| Frijol Pinto Saltillo | ||
| DPPH | 0.796 | 0.7901 |
| ABTS | 0.9863 | 0.9767 |
| FRAP | 1 | 0.9875 |
| Fenoles | - | 0.9875 |
| Frijol Teapa | ||
| DPPH | 0.9888 | 0.9832 |
| ABTS | 0.9654 | 0.9615 |
| FRAP | 0.5289 | 0.5035 |
| Fenoles | - | 0.9915 |
| Frijol Peruano | ||
| DPPH | 0.6407 | 0.6163 |
| ABTS | 0.9298 | 0.9267 |
| FRAP | 0.9428 | 0.9826 |
| Fenoles | 0.9852 | |
De acuerdo a las correlaciones realizadas con las diferentes muestras de frijol, los flavonoides son los principales componentes de los compuestos fenólicos ya que en cada muestra la correlación de fenoles con flavonoides fue muy alta (R2 > 0.96). Estos compuestos parecen ser que son los responsables de conferir la capacidad antioxidante y/o poder reductor en frijol Negro (FRAP), Flor de mayor (DPPH y FRAP), Patol (ABTS y FRAP), Pinto Saltillo (ABTS y FRAP), Teapa (DPPH y ABTS) y Peruano (ABTS y FRAP). Al parecer, los compuestos que conforman a los diferentes extractos de frijol son más afines al radical ABTS que al DPPH, y confieren mayor poder reductor en FRAP. Estas diferencias pueden deberse a que el radical ABTS puede reaccionar con compuestos aromáticos hidroxilados en un amplio rango de pH, factor que limita al radical DPPH ya que trabaja con pH neutros o alcalinos (Prior et al., 2005; Roginsky y Lissi, 2005). Por otra parte, ambos radicales pueden ser donadores de H+ pero el DPPH no reacciona con ácidos aromáticos que contienen solo un grupo OH ni tampoco con fenoles que no contengan un OH en el β-anillo (Yokosawa et al., 1998). Sin embargo, para poder confirmar lo anterior, se deberán identificar por HPLC los compuestos individuales de cada muestra.
Sistema de simulación in vitro del sistema gastrointestinal
En la Tabla 3, se observa el contenido fenólico y actividad antioxidante de las diferentes variedades de frijol cocido y a través de un proceso de digestión in vitro. Los fenoles presentaron un incremento en todas las muestras que van de un rango de 1.14 a 4.62 mgEAG/g, siendo la variedad Teapa la de mayor incremento. Esto pudo deberse a que el proceso de digestión consiguió liberar o dejar más libres a los compuestos fenólicos que están dentro de la matriz alimentaria, por lo tanto están más bioaccesibles. Sin embargo, con los flavonoides pasa lo contrario, parece ser que se degradan o bien se pueden transformar en compuestos con menos actividad antioxidante. Por lo que en este estudio y en otros similares en los que el frijol ha sido remojado, se presenta que el menor nivel de biodisponibilidad de los compuestos se debe a que después del remojo se lleva a cabo la liberación de compuestos fenólicos en el agua en que fueron remojados. Así mismo, Yuwei et al. (2014) presentan valores de frijol sin remojar de 3.24 y 4.86 mg GAE/g en fenoles y valores de 0.24 a 1.38 mgCE/g muy parecidos a los obtenidos en este estudio. Autores como Surangi et al. (2013). mencionan que la biodisponibilidad de los flavonoides es relativamente baja debido a la absorción limitada y rápida eliminación. Más aún, los flavonoides son rápidamente metabolizados y las actividades biológicas de sus metabolitos no son siempre las mismas que las de sus predecesores. Por lo que, la biodisponibilidad de los flavonoides aún no se encuentra bien establecida.
Tabla 3 Contenido fenólico y actividad antioxidante de diferentes variedades de frijol cocido
a través de un proceso de digestión in vitro.
Table 3. Phenolic content and antioxidant
activity of different varieties of cooked beans through an in vitro
digestion process.
| Negro | Flor de Mayo | Patol | Pinto Saltillo | Teapa | Peruano | |
|---|---|---|---|---|---|---|
| Fenoles (mg EAG/g) | ||||||
| Antes de digestión | 1.66±0.13 c | 3.39±0.15a | 2.71±0.03b | 0.68±0.04d | 2.33±0.18b | 2.28±0.16b |
| Después de digestión (Bioaccesibles) | 2.72±0.16d | 3.49±0.10b | 2.96±0.07c | 2.52±0.10c | 4.62±0.11a | 1.14±0.08e |
| Flavonoides (mg ET/g) | ||||||
| Antes de digestión | 0.70±0.038 d | 0.47±0.051e | 0.21±0.019f | 1.41±0.046c | 3.71±0.022a | 2.22±0.064b |
| Después de digestión (Bioaccesibles) | 0.32±0.004 d | 0.37±0.007d | 0.03±0.002e | 0.92±0.005b | 1.65±0.003a | 0.82±0.001c |
| DPPH (µmol ET/g) | ||||||
| Antes de digestión | 2.92±0.06 a | 2.25±0.23a | 1.29±0.12b | 0.58±0.09c | 2.77±0.14a | 1.05±0.29b |
| Después de digestión | 1.50±0.03b | 1.97±0.04a | 0.15±0.10b | 0.33±0.12c | 1.57±0.01b | 0.28±0.13d |
| ABTS (µmol ET/g) | ||||||
| Antes de digestión | 1.91±0.08a | 1.74±0.03b | 0.81±0.12d | 0.52±0.12e | 1.94±0.21a | 1.30±0.14c |
| Después de digestión FRAP (µmol ET/g) | 0.43±0.06c | 1.37±0.08a | 0.23±0.14e | 0.46±0.03c | 1.21±0.03b | 0.33±0.14d |
| Antes de digestión | 14.18±0.12b | 13.02±0.11c | 7.58±0.20d | 5.22±0.04e | 17.8±0.09a | 7.39±0.07d |
| Después de digestión | 10.45±0.05b | 9.53±1.12 b | 6.1±0.77c | 5.87±0.11d | 13.21±1.3a | 5.21±0.92d |
Media ± Desviación estándar /Mean ± standard deviation. Letras diferentes en la misma fila indica diferencia estadística significativa p( < 0.05).
Scalbert y Williamson (2000), indican que existen pocos datos y que una pequeña parte del compuesto es absorbido y como tal encontrado en plasma y orina entre el 7% y el 25% del compuesto ingerido. En cambio, en el plasma humano las concentraciones encontradas después de la ingesta son del orden de 1 μM y decrecen. En nuestro estudio en comparación con el frijol cocido el 78 %, 65 %, 44% y 45% del total de flavonoides fue bioaccesible en el sistema pancreático simulado, para las variedades de Frijol Negro, Flor de Mayo, Pinto Saltillo y Teapa, respectivamente. Sin embargo, la disminución de los flavonoides afectó tanto la capacidad antioxidante por DPPH y ABTS como para el poder reductor en FRAP ya que después del proceso de digestión mostraron un disminución de actividad antioxidante, quedando la mayor actividad en DPPH del 87 %, 57 % y 57 % para Flor de Mayo, Pinto Saltillo y Teapa; en ABTS 79% 88% y 62 % para las mismas variedades. En el poder reductor FRAP hay un incremento del 8.82% en Pinto Saltillo. Estos valores sugieren cambios importantes en los compuestos fenólicos y flavonoides como modificaciones de la estructura química, aumento o disminución de la solubilidad o de la interacción con otros compuestos durante la digestión de las muestras utilizadas, que pueden influenciar en la bioaccesibilidad (Soriano et al., 2015). Sin embargo, a pesar de que hubo una disminución en la capacidad antioxidante, la actividad no es tan baja y podría tener un efecto benéfico en la prevención de enfermedades crónico degenerativas a través de la inhibición de los radicales libres.
Finalmente, aunque hay varios estudios que reportan la bioaccesibilidad y biodisponibilidad de estos componentes de los alimentos, en un intento de entender sus interacciones, debe considerarse que los actuales métodos analíticos para estimarlos en los seres humanos a través de la identificación de los principales metabolitos tienen sus limitaciones. Por lo que hacen falta más estudios para poder explicar a más detalle estos comportamientos.
Conclusiones
De las seis variedades evaluadas de frijol, las muestras Teapa, Pinto Saltillo y Flor de Mayo presentaron un incremento del contenido fenólico, flavonoides, y actividad antioxidante, observándose un efecto positivo al cocimiento. Así mismo, el proceso de digestión in vitro mostró una bioaccesibilidad mayor para compuestos fenólicos. Lo anterior repercutió en una disminución de la capacidad antioxidante, pero a pesar de que hubo esta disminución, la actividad no es tan baja y podría tener un efecto benéfico en la prevención de enfermedades a través de la inhibición de los radicales libres. Sin embargo, se requieren análisis adicionales para profundizar un poco más sobre este estudio, primeramente, determinando los compuestos individuales de cada extracto y posteriormente evaluando cuál de ellos confiere mayor capacidad antioxidante a las muestras después del proceso de digestión.











 nueva página del texto (beta)
nueva página del texto (beta)



