
I. Introducción
El infarto agudo del miocardio representa la causa número uno de muerte a nivel mundial, nuestro país no es la excepción, estimándose 500,000 decesos en los Estados Unidos y alrededor de 80,000 en nuestro país por dicha causa. Por ello la Sociedad Mexicana de Cardiología consideró imperativo la realización de las primeras guías sobre los lineamientos actuales para el diagnóstico y tratamiento del infarto agudo del miocardio con elevación del segmento ST (IMEST), con el objeto de proveer una herramienta práctica y útil para su implementación en la práctica clínica diaria de todos aquellos médicos relacionados con la atención de tales pacientes; el documento ha sido elaborado bajo una cuidadosa selección de expertos en el campo de la cardiología clínica, no invasiva, intervencionista, todos ellos en conjunto con cirujanos cardiovasculares e intensivistas.
Las recomendaciones a continuación vertidas están basadas tanto en la evidencia científica acumulada, como en la experiencia consensada de los involucrados. Por ello y acorde a la nomenclatura mundialmente aceptada, se han estipulado los siguientes niveles de indicación y de evidencia:
Niveles de indicación
Clase I: existe evidencia y/o acuerdo general de que el tratamiento dado es benéfico, útil y efectivo.
Clase II: existe conflicto en evidencia y/o una divergencia de opinión respecto a la utilidad/ eficacia del tratamiento.
IIa: el peso de la evidencia/opinión está a favor de la utilidad/eficacia.
IIb: la utilidad/eficacia del tratamiento está menos sustentada por la evidencia/opinión.
Clase III: existe evidencia y/o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser peligroso.
Niveles de evidencia
Nivel A: existe evidencia científica de al menos dos estudios clínicos aleatorizados.
Nivel B: existe evidencia científica de un estudio clínico aleatorizado, o de meta–análisis, o de varios estudios clínicos no aleatorizados.
Nivel C: existe opinión de consenso de los expertos en base a estudios y experiencia clínica.
A). Concepto, definición y clasificación
El infarto agudo (IAM) se caracteriza por dolor torácico (típico o atípico) sugestivo de isquemia o equivalente isquémico, (síncope, taquicardia ventricular, edema agudo pulmonar, etcétera) en reposo o ejercicio, mayor de 20 minutos, asociado a disnea y actividad simpático–adrenérgica (Tabla I). En más del 85% el principal mecanismo fisiopatogénico es la ruptura de una placa asociada a inflamación, trombosis aguda, (aterotrombosis) vasoconstricción y microembolización. La disminución abrupta del flujo coronario condicionará micro o macronecrosis si no se activa la lisis endógena o se establece un abordaje de reperfusión terapéutico efectivo.

El IAM se define en relación a características clínicas, electrocardiográficas (ECG), bioquímicas y patológicas (Tabla II). La Organización Mundial de la Salud sobre la base de estudios de prevalencia, definió el IAM mediante la presencia de por lo menos dos de los siguientes criterios: 1) dolor torácico sugestivo de isquemia típico o atípico, 2) elevación de marcadores de macro necrosis, 3) cambios ECG característicos con presencia de ondas Q patológicas.1 Por la reciente aparición de biomarcadores (BM) de daño celular agudo, técnicas de imagen y nuevas evidencias sobre la fisiopatogenia del infarto sin elevación del ST surgió la necesidad de buscar una nueva definición actual que permita estandarizar estudios epidemiológicos2 y clínicos.3

El principal criterio para establecer el diagnóstico es demostrar necrosis de las células miocárdicas con síntomas isquémicos, elevación de BM y cambios ECG. Las principales características de esta nueva definición o redefinición incluyen:3
1. Patología. Después de una obstrucción del 100% del flujo coronario por 15 minutos se inicia la necrosis celular,4 caracterizada por coagulación o contracción por bandas de necrosis con apoptosis la cual se establece a las 4 ó 6 horas, dependiendo de la presencia de circulación colateral, oclusión coronaria intermitente, miocardio preacondicionado y sensibilidad de miocitos. Estos hallazgos asociados a infiltración de leucocitos definen un infarto agudo o en evolución (6 horas a 7 días). La presencia de monocitos y fibroblastos, sin leucocitos polimorfonucleares establece un infarto reciente o en cicatrización (7 a 28 días). La presencia de tejido fibroso sin infiltración celular identifica un infarto antiguo o cicatrizado (> 28 días).3–6Por su tamaño se clasifican en microscópicos (necrosis focal), pequeños (< 10%), medianos (10 a 30%) y masivos (> 30%). De acuerdo a su localization en anterior, inferior, lateral, posterior o septal.
2. Bioquímica. La necrosis miocárdica se manifiesta por proteínas liberadas en la circulación como: troponinas cardíacas (TC) T, I y C, mioglobina, creatina–fosfoquinasa (CK), su componente ligado al miocardio (CK–MB) e isoformas, deshidrogenasa láctica (DHL) y sus isoenzimas. La troponina T e I tiene la mayor sensibilidad y especificidad y su principal uso es estratificar el riesgo en síndromes coronarios agudos (SCA) sin elevación del ST.7–10 Otra alternativa con menor especificidad, pero con extenso uso clínico es la CK–MB cuya principal fortaleza es tener una curva de rápido descenso, por lo que es una importante alternativa en casos de reinfarto, a diferencia de la troponina cuyos niveles se mantienen elevados hasta por 21 días3,10,11 (Tabla III).

3. Electrocardiografía. En el infarto agudo tiene alta sensibilidad para demostrar isquemia y necrosis a través de cambios en el ST–T y presencia de ondas Q patológicas. Cuando estas alteraciones quedan enmascaradas o no se presentan, el diagnóstico depende BM de respuesta temprana y tardía.3 Un análisis apropiado identifica la localization y la extensión del miocardio en riesgo y diferentes estadios de su evolución.12 El bloqueo de rama derecha no impide establecer el diagnóstico de infarto a diferencia de la rama izquierda del haz de His (BARIHH) el cual puede ocultar los cambios del segmento ST y onda T. En presencia de este trastorno de conducción una onda Q en V5 y V6 asociado o no a pérdida del voltaje del QRS en V4, V5 y V6 sugieren un infarto septal. La presencia de RS en V4, V5 y V6 como expresión de la derivación intracavitaria del ventrículo izquierdo podría sugerir una lesión transmural anterior. Sin embargo, en presencia de este trastorno de conducción, estos hallazgos no permiten establecer la diferencia entre un evento agudo o una necrosis. Recientemente Topol y Van de Werf establecen que la presencia de un desnivel negativo del ST de VI a V4 en presencia de BARIHH debe considerarse como la expresión de un infarto anterior.12a,12b,13
Electrocardiográficamente la evolución de un infarto con elevación del ST se divide en cuatro fases: 1) hiperagudo, 2) agudo, 3) subagudo y 4) crónico. La primera fase es la manifestación más temprana y se puede observar una onda T alta acuminada que posteriormente se convertirá en una elevación del ST. La depresión del ST como expresión de cambios recíprocos (desnivel horizontal o negativo del ST opuesto a la elevación del ST) indica un infarto más extenso o ruptura múltiple.13,43
4. Alteraciones funcionales. Diversas técnicas de imagen pueden evaluar anormalidades de la perfusión miocárdica como angiografía radionuclear, tomografía computada por emisión de fotón único, SPECT y resonancia magnética nuclear. Mediante otras técnicas se puede evaluar la contractilidad y función ventricular (ecocardiografía, SPECT y RMN). En la evaluación inicial la ecocardiografía bidimensional ofrece información valiosa en relación a la extensión de las alteraciones de la movilidad, identifica complicaciones mecánicas, isquemia a distancia, permite conocer la fracción de expulsión y descarta patologías que se comportan como un infarto.14,15
B). Historia natural y epidemiología
Su historia natural y verdadera mortalidad es difícil de establecer por la heterogeneidad de definiciones y métodos para establecer el diagnóstico, así como por la alta mortalidad prehospitalaria e incidencia de infartos sin expresión clínica. En estudios comunitarios16 la mortalidad estimada a 30 días es del 30 al 50% y la mitad se observa en las primeras dos horas.17Esto no se ha modificado en las últimas décadas, en contraste con la reducción de la hospitalaria lograda gracias a las unidades coronarias, terapia de reperfusión farmacológica y mecánica y nuevos antitrombóticos. 18,19
Epidemiología de la cardiopatía isquémica en México
La cardiopatía isquémica por aterotrombosis coronaria es la forma más frecuente de enfermedad cardiovascular después de los 30 años de edad, y es la principal causa de mortalidad en mundo y en México.20 Datos epidemiológicos de México establecen a la cardiopatía isquémica como primera causa de mortalidad en mayores de sesenta años, segunda causa en la población en general, en el año 2003 fue responsable de 50,000 defunciones y contribuyó aproximadamente al 10% de todas las causas de mortalidad.45 Su incremento en los últimos años es el resultado de un estado inflamatorio endotelial crónico inducido por incremento en la ingesta de macronutrientes, obesidad, tabaquismo y tensión psicológica como posibles principales generadores de aterotrombosis. México tiene una de las tasas más altas en diabetes mellitus y junto con la cardiopatía isquémica constituyen las dos primeras causas de mortalidad.20 La mayor incidencia de mortalidad por enfermedad coronaria se observa en grupos con alta productividad y en adultos mayores, con un claro predominio del sexo masculino. Después de los 75 años se observa una incidencia similar para ambos sexos.20 El impacto económico en nuestro país en el año de 1997 fue de aproximadamente de siete mil millones de pesos,20 además del desequilibrio familiar que genera el fallecimiento o la incapacidad del principal proveedor.
Los SCA con o sin elevación del ST y la muerte súbita en el mundo y en nuestro país son los responsables de la alta mortalidad.
Incidencia, demografía y factores de riesgo de los SCA en México
A través de los datos generados por los registros nacionales RENASICA I21 y II45 que incluyeron 12,351 pacientes, hoy tenemos una perspectiva moderna del comportamiento de los SCA en la fase aguda y hospitalaria.
RENASICA I
Este registro que incluyó 4,353 pacientes con SCA con o sin elevación del ST enfatiza las prácticas actuales y los abordajes terapéuticos en la transición de los siglos veinte y veintiuno. El SCA sin elevación de ST fue la causa más común de admisión hospitalaria y se demostró inaccesibilidad para obtener determinaciones de troponinas. La mayor incidencia fue en el sexo masculino con una prevalencia de diabetes, HAS, tabaquismo e hipercolesterolemia mayor del 50%. En esta forma de SCA fueron indicadores de riesgo edad > 65 años, depresión del ST, macronecrosis y angiográficamente una enfermedad coronaria extensa. La presencia de dolor isquémico típico, disnea y diaforesis tuvieron una relación estrecha con macronecrosis y el diagnóstico final de infarto con elevación del ST. A pesar de que el 90% de los hospitales tenían capacidad para realizar reperfusión farmacológica y/o mecánica, menos de la mitad de los pacientes recibieron este beneficio. En el 70% de los pacientes se empleó un tratamiento antitrombínico y antiplaquetario estándar y en una menor proporción heparina de bajo peso molecular y antagonistas de los receptores de superficie plaquetaria IIb/IIIa. La información proporcionada por el RENASICA I podría ayudar a las autoridades de salud mexicanas para una mejor utilización de los recursos de salud en el tratamiento de los SCA.21,45
RENASICA II
A diferencia de lo observado en el RENASICA I (35% vs 65%) y en otros registros previos, el IMEST fue la causa más frecuente de hospitalización (56%), seguida de angina inestable (AI) e infarto sin elevación del ST. Esto podría atribuirse a las facilidades para reperfusión mecánica y la asociación con otras comorbilidades (diabetes). Estos resultados establecen al IMEST como la principal causa de admisión hospitalaria y ponen de relieve el impacto que tiene sobre los recursos del Sistema de Salud Nacional.
Ambos grupos tuvieron una media de estancia hospitalaria de 8.1 días cercana a lo observado en registros Europeos, pero diferente a los registros Norteamericanos (4.3 días). Aunque la mayoría de los datos demográficos fueron muy similares a otras poblaciones con SCA, en el RENASICA I y II se observó la mayor incidencia de diabetes reportada (50 y 42%) previamente en cualquier otro registro. En el RENASICA II y a nivel mundial, la diabetes sola o asociada con otros estados de inflamación y disfunción endotelial crónica (pacientes de edad avanzada, tabaquismo, hipertensión, lípidos anormales) podría explicar la alta incidencia de IMEST. En la angina inestable (AI) y/o infarto sin elevación del ST (IMNEST), la diabetes tuvo una relación estrecha con mortalidad hospitalaria. En este registro al no evaluar el estado metabólico es lógico considerar que la diabetes y estados de intolerancia a la glucosa y resistencia a la insulina podrían estar subevaluados. Además, no se estableció el porcentaje de obesidad.
El espectro clínico observado demostró como características clínicas importantes en el momento de la presentación, dolor isquémico típico y anormalidades del segmento ST y de la onda T. Un perfil clínico similar se ha descrito en otros modelos de riesgo y confirma los resultados del RENASICA I. La demostración de macro o micronecrosis establece el diagnóstico final, pero no es necesaria para iniciar una estrategia de reperfusión y/o el tratamiento antitrombótico a la medida del paciente.45
Aunque se identificó una tendencia ascendente en el uso de tratamientos antitrombóticos y antiisquémicos estándar en relación al RENASICA I, el uso de nitratos, bloqueadores beta, heparina no fraccionada y heparina de bajo peso molecular fue marcadamente más bajo de lo esperado. El alto uso de inhibidores de la ECA (54%) podría atribuirse a su empleo por otras comorbilidades. En el IMEST el uso de ácido acetilsalicílico, nitratos, inhibidores de la ECA y heparina no fraccionada fue más bajo de lo esperado. En ambos grupos se observó un uso reducido de antagonistas de los receptores de superficie plaquetaria IIb/IIIa (16%) y de estatinas (13%).
La proporción de terapia fibrinolítica (TF) disminuyó del RENASICA I (50%) al RENASICA II, (37%) posiblemente por las facilidades en los centros para realizar intervención coronaria. Sin embargo, las causas de esto deben analizarse detalladamente, ya que una proporción significativa de pacientes ingresaron en ventana para obtener los beneficios de la reperfusión farmacológica. En el IMNEST, el uso de TF (4%) fue similar a lo reportado por otros registros. Aunque en este grupo la TF fue un factor pronóstico importante de mortalidad hospitalaria, un porcentaje alto de los pacientes tuvo inestabilidad clínica, anormalidades del sistema de la conducción, macronecrosis y disfunción ventricular izquierda. Posiblemente la TF se usó como terapéutica de rescate en centros sin posibilidades para realizar reperfusión mecánica. No se observaron complicaciones hemorrágicas mayores. Aunque el porcentaje de intervención coronaria percutánea fue bajo, (15%) estos resultados coinciden con reportes previos. Considerando la proporción significativa de pacientes con DVIEST que no recibieron ninguna estrategia de reperfusión, se requieren nuevas direcciones del Sistema de Salud que permitan mejorar la calidad de la atención médica en este grupo.45
En el IMEST los porcentajes de mortalidad fueron más altos de lo esperado y mayor a lo reportado previamente. Sin embargo, esto no es un hallazgo inesperado ya que una proporción importante de pacientes no tuvieron ninguna facilidad de reperfusión. La disfunción ventricular izquierda fue el evento adverso más importante y el factor pronóstico más poderoso de mortalidad, esto podría relacionarse con la baja incidencia de estrategias de reperfusión y con tiempos más prolongados de isquemia. La experiencia de los centros y el tratamiento antitrombótico intensivo temprano (24 horas) podrían explicar la baja incidencia de complicaciones hemorrágicas mayores y arritmias ventriculares.45
II. Fisiopatología
Los SCA por aterotrombosis22,23 previamente considerados como la expresión final de una enfermedad por depósito de colesterol, hoy el acumulo de la evidencia actual exige entender a la aterogénesis como una compleja interacción de factores de riesgo, células de la pared arterial, elementos hemostáticos y mensajes moleculares. Estudios experimentales y clínicos establecen a la inflamación como un componente fundamental no sólo en todos los estadios vasculares de la aterosclerosis sino que también participa en las complicaciones locales, miocárdicas y sistémicas de este proceso fibroproliferativo.46
A) Formación de la lesión y placa
Cuando el endotelio de la pared arterial se enfrenta a factores de riesgo proinflamatorios y vasoconstrictores como dislipidemia, hormonas, hipertensión, productos de glucooxidación asociados a hiperglucemia o citocinas proinflamatorias derivadas del exceso de tejido adiposo, aumenta la expresión de las moléculas de adhesión lo que promueve adhesión leucocitaria. La trasmigración de estos leucocitos depende en gran parte de la expresión de citocinas reguladas a través de señales asociadas a los históricos factores de riesgo para aterosclerosis. Una vez que los leucocitos se adhieren a la pared, (fagocitos mononucleares y linfocitos T) envían un mensaje a las células del endotelio y del músculo liso de la pared arterial. Los mensajes mayores que se intercambian entre los diferentes tipos de células involucradas en la aterogénesis dependen de mediadores de inflamación e inmunidad, incluyendo moléculas pequeñas como mediadores lipídicos, prostanoides y otros derivados del ácido araquidónico (leucotrienos). Otros autacoides como histamina, clásicamente regulan el tono vascular e incrementan la permeabilidad vascular. Recientemente la atención se ha enfocado sobre proteínas mediadoras de inflamación e inmunidad, incluyendo citocinas y componentes del complemento.
Hace una década las citocinas virtualmente eran desconocidas para el cardiólogo, hoy son piedra angular en esta especialidad. Como consecuencia mayor del proceso inflamatorio subyacente al ateroma inicial, las células del músculo liso migran de la media a la íntima. Estas células proliferan y elaboran una rica y completa matriz extracelular. En concierto con las células endoteliales y monocitos, secretan una matriz de metaloproteinasas en respuesta a varias señales oxidativas, hemodinámicas, inflamatorias y autoinmunes. Esta matriz, en balance con sus inhibidores tisulares endógenos, modula numerosas funciones de las células vasculares, incluyendo activación, proliferación, migración y muerte celular, así como, la formación de nuevos vasos, remodelación geométrica, reparación o destrucción de la matriz extracelular de las arterias y del miocardio. Ciertos constituyentes de esta matriz como los proteoglicanos ligados a lipoproteínas, prolongan su residencia en la íntima y produce mayor susceptibilidad y modificación oxidativa. La respuesta inflamatoria se sostiene y propaga a través de productos modificados de lipoproteínas como fosfolípidos oxidativos y productos avanzados de glucosilación oxidativa. Conforme la lesión avanza se presenta la calcificación por mecanismos similares a los relacionados con la osteogénesis. Además de la proliferación y muerte celular (incluyendo apoptosis) que comúnmente ocurre en lesiones ateroscleroticas establecidas, la muerte de macrófagos puede llevar a depósitos extracelulares de factor tisular. Los lípidos extracelulares acumulados en la íntima pueden coalecer y forman el clásico corazón necrótico–lipídico de la placa.46
La forma incipiente, reversible de lesión coronaria aparece tempranamente en la vida, y evoluciona en el adulto a una placa de ateroma madura que es la causante de cardiopatía isquémica.24
B) Remodelación arterial. Un componente crítico de la aterosclerosis
En la práctica clínica, pocos aspectos de la biología relacionada con aterogénesis han tenido el impacto del concepto actual de la remodelación arterial. El conocimiento de que el grado de estenosis es el mecanismo más importante de la enfermedad arterial coronaria ha dominado por décadas su patofisiología. Nuestra visión se ha limitado al grado de estenosis como expresión de una enfermedad local o segmentaria. Ahora se reconoce que la lesión aterosclerótica crece más hacia el exterior la luz del vaso que hacia el interior. Así que puede existir una sustancial placa de aterosclerosis sin estenosis. Estudios de ultrasonido intravascular confirman en vivo resultados de estudios de necropsia: la estenosis representa "la punta del iceberg". Para el momento que la lesión progresa a una estenosis crítica la aterosclerosis de la íntima usualmente ha crecido en forma difusa y amplia. En Norteamérica estudios con ultrasonido demuestran en adolescentes y adultos jóvenes la prevalencia de este tipo de lesiones. El reconocimiento de la ubicuidad de estas lesiones aterosclerosas que no limitan el flujo tiene importantes implicaciones para el entendimiento de los SCA.46
C) Placa vulnerable
La sociedad de corazón americana25 la define como lesiones en fase 2, tipo Va de contenido rico en lípidos y cubierta fibroendotelial delgada. Este tipo, generalmente no es obstructiva y (estenosis < 50%) tiene un núcleo lipídico blando en forma semilunar con abundantes células espumosas, macrófagos y linfocitos T activados. Cuando se rompe y se observa agregación plaquetaria y trombosis se convierte en fase 3, tipo VI, que constituye la "placa inestable", sustrato patológico de los SCA.25
D) Ruptura
Es un fenómeno frecuente, sin embargo es probable que una buena parte cursen sin expresión clínica.24 Se acompaña de trombosis mural y de hemorragia dentro de la placa que puede condicionar una oclusión total o subtotal.26 Además de la erosión superficial y la fisura profunda,26 se han identificado otros mecanismos como hemorragia intraplaca y erosión de un nodulo calcificado.23a La ruptura ocurre con mayor frecuencia en la porción delgada denominada "hombros" o "cuernos",27,28 en donde la colágena está disminuida y la inflamación tiene importante acción a través de enzimas proteolíticas que disuelven la matriz.29 En la ruptura también participan otros factores biológicos, mecánicos y hemodinámicos.24
E) Trombosis
Se observa en más del 80% de los SCA28 por ruptura profunda y es el mecanismo más importante en infarto con elevación del ST.24 El 20% restante se debe a otros mecanismos previamente mencionados30 (Fig. 1).
La trombosis se inicia con actividad plaquetaria seguida de formación fibrina y termina con la activación de la fibrinólisis endógena, con fenómenos dinámicos de retrombosis y lisis espontánea.24 La agregación plaquetaria mediante el enlace del fibrinógeno con los receptores GPIIb/IIIa, determinan la activación de la cascada de la coagulación con mayor generación de trombina a través de la vía intrínseca. La trombina se adhiere a las plaquetas y actúa sobre el fibrinógeno del trombo plaquetario (trombo blanco) formando una malla de fibrina que se enlaza al plasminógeno y eritrocitos, formando un trombo rojo mural adherido a la pared del vaso. La vasoconstricción local mediada por tromboxano A2 y endotelinas contribuye a disminuir el lumen vascular y determina, conjuntamente con el trombo mural, la oclusión total o subtotal del vaso coronario.33
F) Agregación plaquetaria
El equilibrio entre el endotelio y las plaquetas se pierde con ruptura y exposición de componentes trombogénicos como LDL–ox, factor tisular y moléculas macro–adhesivas como el factor Von Willebrand y el colágeno subendotelial, con lo que se promueve la adhesión plaquetaria a través de receptores glucoproteínicos de superficie como GPIIb y GPIIIa, estableciendo una red de plaquetas en el sitio de la lesión endotelial.31 Las plaquetas se activan a través de un número importante de agonistas como difosfato de adenosina, tromboxano A2 y serotonina secretados por los gránulos plaquetarios, epinefrina circulante y trombina.32 Como resultado de esta activación se inicia el proceso de agregación plaquetaria mediado por las GPIIb/IIIa, estructuras receptoras de enlace con el fibrinógeno circulante y el factor de Von Willebrand, con lo que se constituye la vía final de agregación plaquetaria y formación del trombo.33
G) Fibrinólisis y retrombosis
Las cadenas de fibrina–plasminógeno activan el sistema fibrinolítico al liberar activadores tisulares como t–PA y u–PA (uroquinasa) que transforman el plasminógeno unido a la fibrina en plasmina, iniciando la degradación de fibrina y lisis del coágulo. La plasmina tiene efecto sobre el fibrinógeno, fibronectina y trombospondina e impide la adhesión de las plaquetas del endotelio dañado.34 Esta lisis endógena mediada por la vía intrínseca se complementa con el sistema extrínseco mediado por el factor XII. La reperfusión por lisis mejora la perfusión del miocardio en riesgo y las microembolias de fibrina y plaquetas forman parte en la génesis de arritmias cardíacas, síndrome de reperfusión, fenómeno de no–reflujo y muerte súbita.35
III. Diagnóstico inicial y estratificación temprana de riesgo
Un servicio de Urgencias tiene como principal objetivo identificar pacientes en quienes una intervención temprana puede modificar favorablemente la evolución en la fase aguda (Tabla IV y Fig. 2).

A) Presentación clínica
Sospecha de infarto: dolor torácico en reposo o ejercicio, típico de isquemia o atípico > 20 minutos de duración.36 El dolor típico es retroesternal opresivo e irradia al hombro y brazo izquierdo. El atípico se puede observar en epigastrio, espalda, etcétera. La intensidad es variable, desde muy intenso hasta una molestia leve. En adultos mayores puede ser reemplazado por equivalentes de isquemia como, disnea, fatiga, lipotimia o síncope. La activación del sistema simpático (sudoración, palidez, náusea y vómito) es un elemento clínico muy importante.20
Antecedentes de enfermedad coronaria y factores de riesgo históricos son fundamentales en el proceso de diagnóstico y estratificación. Aunque no existen signos físicos característicos, manifestaciones de disfunción ventricular (tercer ruido ventricular izquierdo, hipotensión, estertores, hipertensión venocapilar, fracción de expulsión < 40%) sugieren un área de miocardio en riesgo extensa y confieren un riesgo alto36 (Tabla I).
B) Electrocardiograma
Debe obtenerse en forma inmediata y requiere de un análisis cuidadoso, incluyendo aVR en donde un desnivel positivo del ST sugiere una enfermedad proximal crítica. Rara vez es normal37,38 y a través del análisis del ST y onda T es posible establecer un diagnóstico y elegir un tratamiento de reperfusión o sólo tratamiento estándar antitrombótico. Si existen dudas razonables se sugiere tomarlo en forma seriada. El registro de V7 y V8 es útil para identificar isquemia posterior. Un monitor identifica arritmias potencialmente fatales.36
C) Biomarcadores
Aunque son muy importantes en el diagnóstico, estratificación y tratamiento de los SCA el registro nacional RENASICAII demostró que su aplicación es muy limitada.45 No obstante, en el momento actual se cuenta con marcadores de necrosis, disfunción ventricular e inflamación. En un futuro, la información obtenida a través de biomarcadores de inestabilidad de placa e isquemia permitirá identificar pacientes de riesgo alto en estadios muy tempranos de la enfermedad coronaria aguda y antes de que se establezca la necrosis y/o disfunción ventricular.
Marcadores de necrosis miocárdica
Troponina
La Sociedad Americana y Europea de cardiología recomiendan analizar los marcadores de necrosis sobre un apropiado contexto clínico sobre la base de que es posible obtener niveles elevados de troponina sérica en muchas condiciones clínicas como insuficiencia cardíaca, hipotensión asociada a arritmias, enfermos en estado crítico, miocarditis, pericarditis, tromboembolia pulmonar, hipertensión arterial pulmonar crónica grave, traumatismo cardíaco, estados avanzados de insuficiencia renal, etcétera.46a Su principal valor es la alta sensibilidad para identificar infartos pequeños, se eleva entre 4 a 10 horas después del inicio de los síntomas, con elevación máxima a las 12 ó 48 horas y puede persistir hasta por 21 días. No tiene utilidad en el diagnóstico de reinfarto. Se recomiendan tres determinaciones, una basal en urgencias, a las 6 y 12 horas. Cualquier valor elevado de troponina se relaciona con mayor riesgo para eventos adversos cardiovasculares. No hay ninguna evidencia que demuestre que un umbral bajo de troponinas tenga menor riesgo y mejor pronóstico, por lo que cualquier cifra anormal deberá ser considerada. No obstante el importante avance que ha significado la inclusión de estos biomarcadores en el diagnóstico y estratificación del infarto, aun en la "era de las troponinas" el diagnóstico sigue siendo clínico.46a
Mioglobina
Es el biomarcador más rápido (1 a 2 horas) para demostrar lesión celular aguda, su elevación máxima se observa entre las 6 y 12 horas despues del inicio de los síntomas y regresa a la normalidad en las siguientes 24 horas. Por su baja especificidad se requieren determinaciones de troponina simultáneas para confirmar daño miocárdico y eliminar falsos positivos. Se recomienda una determinación basal en urgencias y a las 4, 8 y 12 horas.46a
Marcadores de inflamación
En la fisiopatogenia de los SCA existe suficiente evidencia que apoya la participación de la inflamación local y sistémica. El más estudiado ha sido la proteína C reactiva por su relación con inflamación, enfermedad coronaria y evolución. Se ha demostrado un valor predictivo independiente y agregado cuando se asocia con troponinas. Aún más, parece tener importante valor pronóstico en ausencia de micro y macronecrosis. Los leucocitos parecen ser otro marcador que refleja inflamación. Una cuenta leucocitaria > 10,000 se ha asociado con mayor incidencia de eventos cardiovasculares adversos y mortalidad. En la estratificación de riesgo de los SCA por su accesibilidad y bajo costo representan una alternativa muy atractiva. Sin embargo, se requiere mayor evidencia para determinar si con estos marcadores es posible ofrecer una terapéutica específica.46a
Marcadores de disfunción ventricular
Incluyen péptido natriurético auricular (PNA) y el natriurético tipo–B, (PNB) ambos dentro de un contexto clínico pueden evaluar la función cardíaca. El primero es secretado por los cardiomiocitos auriculares y el segundo por ambos ventrículos. Los mecanismos exactos a través de los cuales se regula su producción y secreción son desconocidos, aunque el estiramiento e incremento en la tensión de la pared podrían tener una participación importante. Sus concentraciones plasmáticas se pueden elevar por: a) exceso de volumen como en insuficiencia renal, aldosteronismo primario e insuficiencia cardíaca congestiva, b) estimulación en su producción como se ha demostrado en hipertrofia ventricular por sobrecarga de presión, enfermedad tiroidea, exceso de glucocorticoides e hipoxia. Aunque su principal indicación es demostrar la presencia de disfunción sistólica o diastólica del ventrículo izquierdo y ha demostrado ser un importante marcador de riesgo en tromboembolia pulmonar, evidencias recientes sugieren que podría tener utilidad en la estratificación de SCA.
Esto emerge de datos obtenidos de pacientes con SCA con y sin elevación del ST, con o sin evidencia de micronecrosis y con o sin datos de disfunción ventricular. Sin embargo, se requieren mayores datos para conocer su verdadera interpretación clínica en el escenario de la enfermedad coronaria inestable.
D) Ecocardiografía
En urgencias es de gran valor para evaluar pacientes con sospecha de SCA.14 Las anormalidades de la contracción segmentaria ocurren inmediatamente después de la oclusión coronaria, mucho antes que se presenten cambios electrocardiográficos y dolor.39 Sin embargo, los trastornos de movilidad global o segmentario no son específicos (Tabla V). Esta técnica permite identificar o descartar otras causas de dolor torácico, como disección aórtica aguda, pericarditis, taponamiento y tromboembolia pulmonar submasiva o masiva.14,15

E) Estratificación de riesgo
Este proceso incluye identificar: factores de riesgo que modifican el pronóstico de mortalidad temprana y aquellos pacientes que pudieran obtener un beneficio mediante una estrategia de reperfusión inmediata farmacológica o mecánica.
Aunque existen varios modelos de puntaje para estratificar el riesgo de mortalidad, las variables que históricamente tienen mayor consistencia son: edad > 65 años, historia de infarto, insuficiencia cardíaca previa, diabetes y manifestaciones de disfunción ventricular.40,41 El índice de riesgo TIMI para mortalidad a 30 días en pacientes con infarto y elevación del ST41 se basa en 9 variables clínicas que pueden evaluarse fácilmente en el momento del ingreso (Tablas VI, VII y VIII). No obstante que parece ser un importante predictor de mortalidad a 30 días, al igual que otros índices de puntaje, deriva de un subestudio y no ha sido revalidado en nuestro medio.



F) Otras técnicas de diagnóstico
Estudios de imagen radionuclear (IRN) y resonancia magnética nuclear (RMN) son técnicas utilizadas con menor frecuencia para el diagnóstico de infarto.
1. Imagen radionuclear. Es de gran utilidad para la evaluar SCA sin elevación del ST y para detectar isquemia residual y de miocardio en riesgo posterior a un infarto. Estos estudios se realizan en reposo y después del estrés provocado por fármacos (adenosina, dipiridamol, dobutamina) o del ejercicio, utilizando talio201, tecneciom99 (sestamibi) o ambos con la técnica de SPECT. El estudio de IRN proporciona además información sobre el volumen y FE del ventrículo izquierdo, contractilidad segmentaria, la extensión del miocardio dañado y del miocardio en riesgo. La confirmación de necrosis miocárdica durante la fase aguda del infarto puede realizarse mediante gammagrafía con pirofosfato de tecnecio ("lesión caliente", detectable 24 horas después del infarto), o mediante gammagrafía de redistribución con talio201 ("lesión fría"). No se utilizan para el diagnóstico temprano de un infarto.47
2. Resonancia magnética nuclear.49,50 Es útil para estudiar la función cardíaca y la perfusión miocárdica usando gadolinio como material de contraste; permite detectar isquemia residual y miocardio viable al revelar anormalidades del grosor y contractilidad parietal segmentaria, en pruebas de estrés farmacológico (dobutamina) o con el ejercicio; determina la presencia de defectos de perfusión como criterio de necrosis miocárdica; y mediante técnicas especiales como la angio–resonancia coronaria permite caracterizar la morfología de las arterias coronarias epicárdicas, así como el estudio de la placa ateromatosa. No tiene indicación en el manejo agudo de un infarto. Su utilidad principal es en la evaluación y estratificación del paciente post–infarto, o en pacientes con isquemia estable crónica.
G) Algoritmo de abordaje diagnóstico del paciente con IMEST
Durante el abordaje inicial por parte del clínico, tendrá que tener en cuenta las posibilidades de dolor no cardíaco, isquemia estable o de un SCA. En caso de un SCA debe establecerse si tiene o no elevación del ST. En el caso de un SCA con elevación del ST de acuerdo a los recursos disponibles debe intentarse una estrategia de repercusión farmacológica o mecánica. En la Figura 2 se puede observar una ruta crítica que podría utilizarse en pacientes con sospecha de un SCA.
IV. Manejo inicial del paciente
Independientemente de que se pueda realizar o no una estrategia de reperfusión y aunque la evidencia no es la mejor, a continuación se analizan acciones terapéuticas aceptadas universalmente que permiten ofrecer una mejor atención a los pacientes con SCA y elevación del ST.
Oxígeno
La forma de administración depende del estado clínico del paciente. En enfermos en KK I–II y saturación > 95% se recomienda utilizar oxígeno a través de narinas con un flujo máximo de 3 L por minuto, por la falta de evidencia y el costo se recomienda utilizarlo únicamente durante las primeras seis horas. En pacientes con enfermedad pulmonar obstructiva crónica se debe administrar con precaución, además su uso excesivo puede inducir vasoconstricción sistémica. Aunque no es posible determinar si esta terapéutica reduce miocardio en riesgo y mejora la morbimortalidad, estudios experimentales y clínicos de la década de los años setenta sugieren que podría limitar la isquemia y disminuir el ST.50a,50c El mayor beneficio se obtiene en presencia de alteraciones de la ventilación–perfusión por edema pulmonar intersticial y/o alveolar como expresión de hipertensión veno–capilar y disfunción del ventrículo izquierdo. En pacientes con edema en fase alveolar y dependiendo del trabajo respiratorio, fatiga de músculos respiratorios y/o hipoxemia (saturación < 90%) se puede utilizar ventilación mecánica invasiva o no invasiva.54a–58a Su principal beneficio es romper los mecanismos de insuficiencia respiratoria y eliminar los efectos deletéreos sobre miocardio y vasculatura pulmonar y sistémica. La distribución regional de la perfusión pulmonar de un infarto no complicado es anormal, por hipoperfusión de las bases, una mayor perfusión en los vértices, lo que con una distribución regional de la ventilación normal, establece una relación V/Q casi constante desde el vértice hasta la base del pulmón. Esta distribución anormal de la perfusión se atribuye a un posible incremento imperceptible del líquido pulmonar intersticial, con discreta ingurgitación del tejido intersticial perivascular, peribronquial y tal vez de la pared alveolar, secundaria a disfunción diastólica transitoria y silente del ventrículo izquierdo, la perfusión retorna a la normalidad alrededor de las siguientes tres semanas.54a–58a
Morfina y derivados
El principal síntoma en la mayoría de los pacientes con infarto y elevación del ST es el dolor torácico. Considerando que la intensidad depende de una sensibilidad individual y que estos medicamentos pueden inducir como efecto adverso directo o por sinergismo (nitratos, estreptoquinasa, bloqueadores beta, etcétera) un estado de hipotensión arterial sistémica, es necesario realizar una evaluación cuidadosa para elegir la mejor estrategia a la medida del paciente. El raciocinio para tratar un dolor intenso se basa en la hiperactividad simpática que se genera en la fase temprana de la oclusión y la posibilidad de que las catecolaminas participen en la fisura de la placa, propagación del trombo y en establecer un menor umbral para fibrilación ventricular.51a Utilizar la disminución de la intensidad del dolor como criterio de reperfusión farmacológica evita que algunos pacientes reciban tratamiento. Esto debe evitarse si el dolor es muy intenso e interfiere en la evolución. En muchos casos el control se hace a través de la combinación de oxígeno, morfina, nitratos y bloqueadores beta. No obstante que la morfina es el analgésico de elección, se pueden utilizar otros derivados como nalbufina y buprenorfina. La dosis estándar de morfina es 2 a 4 mg IV con incremento de 2 a 8 mg cada 5 a 15 minutos, (nivel de evidencia C) sin embargo, ésta debe ajustarse en relación a edad, peso y cifras de tensión arterial. Su principal efecto es reducir la frecuencia cardíaca y en forma secundaria la demanda de oxígeno. Sus principales efectos colaterales son hipotensión y depresión del centro respiratorio, este efecto se revierte con naloxona 0.1 a 0.2 mg por vía endovenosa.52a
Nitratos
En el escenario de un infarto tienen dos efectos importantes, por una parte reducen pre y postcarga a través de vasodilatación arterial y venosa, mejoran el flujo coronario mediante relajación de las arterias epicárdicas y dilatación de la circulación colateral con lo que se obtiene una mejor proporción de flujo epicárdico y subendocárdico. Por otra, como donadores indirectos del óxido nítrico pueden atenuar la disfunción endotelial en los segmentos adyacentes a la ruptura de la placa y en otras áreas de la circulación coronaria13 lo que disminuiría la vasoconstricción.59a La nitroglicerina y todos sus derivados han demostrado efectos benéficos en enfermedades vasculares caracterizadas por disfunción endotelial y deficiencia de óxido nítrico. Sin embargo, en la fase aguda la evidencia actual establece un beneficio clínico modesto, requiriéndose tratar 1,000 pacientes para evitar 3 ó 4 fallecimientos.53a La nitroglicerina o el dinitrato de isosorbide tiene indicación en presencia de disfunción ventricular. No se recomiendan con tensión arterial sistólica < 90 mm Hg, bradicardia o taquicardia. En presencia de un infarto con extensión al ventrículo derecho con datos clínicos y/o ecocardiográficos de disfunción ventricular importante pueden inducir hipotensión grave ya que este ventrículo requiere una precarga adecuada para mantener el gasto. Al igual que en otras guías52a no se recomiendan con la utilización de inhibidores de la fosfodiesterasa por disfunción eréctil. Se puede generar un sinergismo que podría establecer un estado de hipotensión mediado por la liberación del óxido nítrico y el incremento del monofosfato de guanosina cíclico. El principal riesgo se observa en las siguientes 24 horas posteriores a su administración (48 horas para tadalafin). La nitroglicerina (0.4 mg) y el dinitrato de isosorbide (5 mg) se utilizan comúnmente por vía sublingual. En la fase aguda la absorción por esta vía tiene limitaciones ya que la salivación se encuentra alterada por la actividad simpática, aumento de la frecuencia respiratoria, etcétera. Un bolo endovenoso de dinitrato de isosorbide es más efectivo (1 mg) y seguro que esta vía. Una infusión permite al clínico titular la dosis de acuerdo a la tensión arterial y frecuencia cardíaca del paciente.
Ácido acetilsalicílico
Una característica fundamental de la aterosclerosis coronaria es la tendencia a la formación de trombos con obstrucción coronaria e isquemia secundaria. En el infarto con elevación del ST el principal objetivo terapéutico debe ser inducir e inhibir con efectividad y rapidez, fibrinólisis, actividad plaquetaria y producción de trombina.
El ácido acetilsalicílico (AAS) inhibe indirectamente la activación plaquetaria al inactivar en forma irreversible la enzima ciclooxigenasa y detener producción de tromboxano A2 y agregación plaquetaria.60a,61a Estudios de fase III demostraron que el AAS solo o combinado con estreptoquinasa disminuye mortalidad y reinfarto no fatal en 1%, sin incrementar el riesgo de complicaciones hemorrágicas. En pacientes con enfermedad vascular reduce eventos adversos como infarto, accidente cerebral y muerte cardiovascular. Meta–análisis recientes sugieren que independientemente del fibrinolítico utilizado y del éxito o fracaso terapéutico, el AAS disminuyó isquemia recurrente (56%), reoclusión angiográfica (39%), reinfarto (25%), accidente vascular cerebral (25%) y muerte cardiovascular (15%).62 Este antiadhesivo plaquetario por su bajo costo, fácil administración, mínimos efectos secundarios y el beneficio demostrado como prevención secundaria durante la fase aguda y en el seguimiento, puede considerarse como el medicamento más importante y completo en el tratamiento del infarto con elevación del ST.
Limitaciones. A pesar de su efectividad como prevención primaria,63a secundaria, 64a y en el infarto agudo,60a en un grupo imposible de identificar clínicamente, existe fracaso terapéutico expresado por eventos isquémicos recurrentes. Esto puede atribuirse a los siguientes factores: a) débil inhibición plaquetaria; b) no evita la adhesión plaquetaria inicial en el daño endotelial, c) no impide que el fibrinógeno se adhiera a su receptor, d) no evita la inhibición de la síntesis de prostaciclina; f) por su baja actividad plaquetaria, las catecolaminas pueden atenuar su efecto; g) no inhibe agregación plaquetaria en áreas de alta fricción y estenosis (lesiones críticas); h) falta de respuesta (recurrencia 30 a 40%) y resistencia (a 7 días, 10% sin ningún efecto); i) cualquier dosis puede causar gastritis o hemorragia; y j) posible interacción adversa con otros medicamentos, como inhibidores de la enzima convertidora de la angiotensina.
Bloqueadores beta
Se deben administrar inmediatamente por vía oral u endovenosa en todo paciente con infarto agudo y sin contraindicaciones, independiente de la estrategia de reperfusión considerada. En estudios controlados han demostrado disminuir la incidencia de infarto agudo.65a Su principal efecto consiste en modular la hiperactividad simpática inducida por la disfunción parasimpática lo que permite retomar la variabilidad de la frecuencia cardíaca, principal mecanismo que disminuye el umbral para arritmias ventriculares graves.66a Por su efecto sobre el nodo AV disminuyen el consumo de oxígeno, lo que en lesiones críticas limita la extensión y disminuye isquemia recurrente y mortalidad.67a La utilidad por vía endovenosa ha sido claramente demostrada y deben utilizarse en todo paciente sin contraindicaciones como bradicardia, bloqueo AV, hipotensión, edema pulmonar (por disfunción sistólica), e historia de broncoespasmo.683 En la práctica el paciente ideal para recibir tratamiento combinado con nitratos y bloqueadores beta por vía endovenosa tiene una edad < 60 años, manifestaciones de hiperactividad simpática manifestadas por taquicardia y cifras de TA en límites superiores o con hipertensión arterial sistémica leve, sin ninguna patología crónica preexistente, con adecuada superficie corporal y con una FE normal. En presencia de taquicardia y antes de iniciarlos se debe descartar hipovolemia o fases iniciales de disfunción ventricular sistólica. Pueden utilizarse en cualquier forma de disfunción diastólica. Desafortunadamente este grupo de pacientes no es frecuente y la gran mayoría tienen dentro de su sustrato clínico una o más contraindicaciones para su empleo.
Heparina no fraccionada
Mucopolisacárido con actividad anticoagulante por interacción con el inhibidor endógeno de la trombina y antitrombina III. Induce cambios estructurales en la antitrombina III, acelerando 1,000 veces su unión con la trombina. La heparina también actúa como una ligadura que acerca a la trombina con la antitrombina III.69a El complejo heparina–antitrombina III puede inhibir también la actividad de los factores Xa, Xlla, Xla y IXa, aunque el más susceptible para la inhibición, el factor Xa, es 10 veces menos susceptible que la trombina.69a3 En el momento actual existe suficiente evidencia del efecto benéfico de la heparina en SCA sin necrosis al disminuir la incidencia de infarto.70a–72a Cuando se comparó heparina más AAS versus AAS solo, se observó una disminución de eventos isquémicos como muerte, infarto o isquemia recurrente en un 19 y 28% respectivamente (p = 0.09).73a Estos datos apoyan el hecho de que la combinación heparina–AAS ofrece beneficios y su empleo se encuentra justificado en pacientes con cualquier SCA. La variación del efecto anticoagulante se ha atribuido a la heterogenicidad de las moléculas, al efecto inhibitorio de los factores circulantes del plasma y a las proteínas liberadas por la actividad plaquetaria.69a Para tener un efecto anticoagulante adecuado se sugiere vigilar el tiempo de tromboplastina parcial activada (TTPa) a las 6, 12, y 24 horas y posteriormente cada 24 horas mediante titulaciones realizadas con un nomograma estándar. El TTPa se debe revisar a las 4–6 horas cada vez que se ajuste la dosis. El uso de un nomograma estándar minimiza la variabilidad al ajustar las dosis y ha demostrado mejorar el rango de un TTPa determinado. Aunque no se han comparado dosis estándar versus dosis reducida, se recomienda iniciar con un bolo de 4,000 U seguido de una infusión de 1,000 U/hora tratando de alcanzar un TTPa entre 50 y 70 segundos en relación al testigo.
Heparina de bajo peso molecular
Se obtiene a través de la depolimerización de la heparina estándar no fraccionada.74a,75a Las principales ventajas sobre la heparina convencional son: a) inhibir tanto la actividad de la trombina como la del factor Xa, con lo que se disminuye la generación de trombina.82 b) inducir una mayor liberación del inhibidor de la vía del factor tisular y c) no es neutralizada por el factor plaquetario 4. Desde el punto de vista de seguridad, la heparina de bajo peso molecular no incrementa la permeabilidad capilar,74a,75a y la posibilidad de inducir trombocitopenia es menor.76a Finalmente su alta biodisponibilidad permite administrarla por vía subcutánea y utilizarla por periodos prolongado con lo que podría obtenerse una estabilización sostenida de la placa inestable. Por otra parte han probado innegablemente su beneficio en la profilaxis de la trombosis venosa profunda y tienen un índice menor de complicaciones hemorrágicas.76a En pacientes con cualquier variedad de SCA, el empleo de heparinas de bajo peso molecular más aspirina han reducido significativamente la mortalidad cuando se han comparado con aspirina sola.77a
A continuación hacemos un resumen de las direcciones terapéuticas iniciales en pacientes que no recibieron ninguna estrategia de reperfusión por contraindicación, o llegar fuera de ventana terapéutica o no contar con recursos.
A) Medidas generales
1. Reposo absoluto las primeras 12 a 24 horas de acuerdo a su evolución clínica, en semifowler y sin vendaje de miembros inferiores, con registro continuo de ECG para detectar arritmias.51 Nivel de evidencia C.
2. Dieta: ayuno las primeras 6 horas que se debe mantener si existe inestabilidad clínica y/o hemodinámica
3. Oxígeno y saturación arterial: en todos los pacientes durante las primeras 6 ó 12 horas; (Clase Ha) > 12 horas si la saturación es < 90% secundaria a inestabilidad clínica52 (clase I). Nivel de evidencia C.
4. Si el dolor es intenso la morfina es el analgésico de primera elección, también se pueden utilizar derivados (nalbufina, buprenorfina).53 Si ninguno es accesible se puede utilizar cualquier analgésico disponible. Nivel de evidencia C. Además de disminuir el dolor disminuye la respuesta de catecolaminas. No se recomienda en pacientes con tensión arterial sistólica < 90 mm Hg a menos que la hipotensión se atribuya a la intensidad del dolor.
Nitratos: se pueden utilizar en fase aguda por vía endovenosa para manejo de síntomas, hipertensión arterial sistémica y congestión pulmonar, aunque el impacto sobre la mortalidad es bajo (disminución de 5%). Nivel de evidencia A.54–56 No se recomienda su uso continuo después de 24 hrs a menos que exista isquemia recurrente o congestión pulmonar.
Se recomienda su uso en:
Dolor isquémico persistente, hipertensión venocapilar pulmonar, infarto anterior extenso en primeras 24 h, hipertensión arterial sistémica no controlada. Clase I.
Nitratos SL o transdérmica. Clase II
Pacientes con TAS < 90 mm Hg, bradicardia < 50 por minuto y extensión al ventrículo derecho. Clase III.
1. Ansiolíticos: usar en todos los pacientes ya que disminuye el consumo de O2, la frecuencia cardíaca y presión arterial. No se recomienda cuando la saturación es baja.57 Clase IIb.
Resumen del manejo
1. En urgencias
a. Monitorización cardíaca continua
b. Acceso venoso
2. Manejo del paro cardíaco nos guiamos por el ACLS y se define como el cese de la actividad mecánica del corazón, confirmado por la ausencia de conciencia (Fig. 3).
3. Una taquicardia ventricular y/o fibrilación ventricular es una complicación relativamente frecuente en Urgencias, el manejo detallado se describe en la Figura 4.
4. Finalmente la asistolia, otra complicación frecuente en presencia de enfermedad coronaria muy avanzada puede observarse durante la fase aguda de un infarto, el manejo se resume en la Figura 5.
B) Terapia farmacológica en paciente NO reperfundido
1. ASA: antiagregante plaquetario que debe administrase de inmediato al ingreso en dosis de 325 mg masticada (recomendación Clase I), posteriormente 100 mg/día. Bloquea la vía de la ciclooxigenasa I de las plaquetas, inhibe el tromboxano A2, disminuye adhesividad plaquetaria. Reduce mortalidad (1 vida salvada por 40 tratados en la fase aguda) y el reinfarto, (1 reinfarto no fatal por 100 pacientes tratados). Nivel de evidencia A.58,59
2. Tienopiridinas (ticlopidina, trifusal y clopidogrel).
Su mecanismo de acción es por el bloqueo del receptor del ADP, son medicamentos de segunda elección cuando existe contraindicación a aspirina.
a. Clopidogrel a una dosis inicial de 300 mg VO seguida de 75 mg día. Clase I, nivel de evidencia B.
b. Ticlopidina dosis de 250 mg c/12 hs. Clase Ha, nivel de evidencia B.
c. Trifusal dosis 300 mg c/8 hs. Clase IIb, nivel de evidencia B.
3. Bloqueadores beta Clase IA si no hay contraindicación (antecedentes de asma, bradiarritmias, FC de 50 latidos o menos, hipotensión arterial sistémica, insuficiencia cardíaca congestiva) iniciar en las primeras horas del infarto. El estudio ISIS 1 demostró que en las primeras 24 hs reduce mortalidad (29%). Se recomienda iniciar a dosis bajas.60–62
Metoprolol: dosis IV de 1 mg/min hasta 5 mg en bolo hasta alcanzar 15 mg, seguida de la vía oral a dosis de 100 a 200 mg c/24hs.
Atenolol: 5 mg IV, pudiendo repetirse en 5 a 10 min. Dosis oral de 50 a 100 mg/día.
Carvedilol: Iniciar con una dosis de 3.125 mg/ día, incrementándola cada tercer día hasta 12.5 a 25 mg/día.
4. Inhibidores de enzima convertidora de angiotensina: su uso en las primeras 24 hs a dosis bajas, en pacientes hemodinámicamente estables con fracción de expulsión baja e insuficiencia cardíaca congestiva, han demostrado reducción en la mortalidad. Su principal mecanismo es disminuir la remodelación ventricular posterior al infarto del miocardio.63 Clase IA. También protege la función renal en pacientes con diabetes mellitus.
5. Anticoagulantes
d. Heparina no fraccionada (HNF) y de bajo peso molecular (HBPM) (Enoxaparina) Clase I. Nivel de evidencia A.
HNF: dosis 5,000 UI en bolo seguida de infusión continua a 1,000 unidades hora, manteniendo TTPa entre 55 y 80 segundos.
HBPM: dosis de 1 mg/kg/c/12 hs, ajustar dosis en caso de insuficiencia renal a 1 mg/ kg/c/24 hs, > 75 años 0.5 a 0.75 mg/kg/c 12 hs, obesidad mórbida dosis máxima 100 mg/kg/c 12 hs.
e. Hirudina es un inhibidor directo de la trombina, se recomienda en caso de intolerancia a la heparina y trombocitopenia inducida por heparina Clase IA.
f. Warfarina se debe iniciar en ciertas condiciones clínicas como:
FE < 40% asociado a insuficiencia cardíaca postinfarto, infarto anterior extenso con trombo en ventrículo izquierdo, fibrilación auricular persistente y refractaria a cardioversión eléctrica o farmacológica, INR 2–3. Evidencia A.64,65
6. Inhibidores de GPIIbIIIa. Son otro grupo de antiplaquetarios, se usan junto con ASA y heparina. Indicado en pacientes con dolor isquémico recurrente candidatos a intervención coronaria percutánea, Clase IIa.
Nivel de evidencia A.66,67
7. Estatinas: Clase I. Nivel de evidencia A.
La mayoría podría recibir estatinas a dosis altas en las primeras 48 hs, aunque su mejor efecto se ve después de la fase hospitalaria. Evidencias recientes demuestran que el beneficio va más allá de reducir los lípidos ya que a través de su mecanismo pleiotrópico puede mejorar la disfunción endotelial expresada por menor índice de trombosis, mejor fibrinólisis endógena y menor agregación plaquetaria.68,69,540,541
8. Glucosa–insulina–potasio (GIK): Clase III. Nivel de evidencia B.
La modulación metabólica parece que se puede lograr durante las primeras 24 horas del infarto del miocardio con la infusión de glucosa e insulina (GIK), algunos estudios con muestras reducidas sugieren menor mortalidad, ICC, y arritmias ventriculares mortales.70 Sin embargo, evidencias recientes emanadas del estudio CREATE70a no reprodujeron estos resultados.
V. Terapia fibrinolítica
A) Estrategias de reperfusión
En la fase temprana de un infarto del miocardio con elevación del ST (IMEST) tienen como principal objetivo restituir y mantener la perfusión tisular.71 Después de un evento agudo, el pronóstico a corto y largo plazo depende de la rapidez y calidad de reperfusión72 en la macro y microcirculación para limitar la extensión y conservar función ventricular. La presencia de flujo TIMI III con mala perfusión tisular establece la necesidad de reconsiderar la "hipótesis de la arteria abierta" y extenderla a un concepto más moderno y funcional, la "hipótesis de la vasculatura abierta", caracterizada por un flujo dependiente de tiempo, temprano y completo en la circulación epicárdica y completo y sostenido en la microcirculación. Lo primero puede alcanzarse con intervención coronaria percutánea (ICP) y lo segundo a través de terapia fibrinolítica (TF).71,73
La calidad de reperfusión obtenida con la ICP y la rapidez de la TF, establecen a ambos procedimientos como importantes opciones terapéuticas73 e impide establecer alguna superioridad entre uno y otro procedimiento. La consistencia de la ICP para restaurar permeabilidad y reducir mortalidad deriva de estudios de difícil evaluación por muestras reducidas, heterogeneidad en el diseño, sesgos en la selección de pacientes y tratamiento adjunto heterogéneo.74 El beneficio de la TF sobre mortalidad y función ventricular deriva de datos obtenidos principalmente en < 75 años, prácticamente sin disfunción ventricular y sin enfermedades crónicas avanzadas.
En la era moderna del tratamiento del IMEST la mejor estrategia de reperfusión dependerá del área de miocardio en riesgo, tiempo de isquemia, accesibilidad, experiencia, cultura hospitalaria y tecnología disponible. Independientemente del nivel de atención (A o B) de los SCA4 cada institución debe establecer estrategias para iniciar TF en los primeros 30 minutos de su ingreso a urgencias o realizar ICP (primera inflación o malla endovascular directa) dentro de los primeros 90 minutos (ideal 60 minutos)75 de su ingreso al hospital.
Terapia fibrinolítica
Por la accesibilidad y significativa reducción en mortalidad y eventos adversos demostrada en cientos de miles de pacientes, la TF debe considerarse como el tratamiento estándar del infarto agudo. Se requirió una década de investigación76 para entender la ñsiopatogenia, aceptar que la oclusión por un trombo es la causa directa del infarto77 y que al restaurar la permeabilidad de la arteria responsable es posible rescatar miocardio en riesgo.78 No obstante esta evidencia y los avances obtenidos, sólo un grupo reducido es considerado (< 30%) para reperfusión farmacológica. En nuestro medio contamos con agentes no fibrino–especíñcos como la estreptoquinasa y fibrino–específicos como alteplasa y tenecteplasa (Tabla IX).

A través de niveles de evidencia ponemos a consideración recomendaciones contextualizadas a nuestro medio para identificar pacientes que pudieran obtener el mayor beneficio con el menor riesgo de complicaciones hemorrágicas.
B) Selección del paciente para terapia fibrinolítica
Indicación absoluta
Nivel de evidencia IA
• Dolor torácico sugestivo de isquemia > 20 minutos
• Elevación persistente del segmento ST
—> 0.01 mV en dos o más derivaciones bipolares
—> 0.02 mV en dos derivaciones precordiales subyacentes
• Killip y Kimbal I y II
• Bloqueo de rama izquierda del haz de His (BRIHH)
—< 6 horas de inicio de los síntomas
— Sin contraindicación absoluta
La TF debe iniciarse en un tiempo < 30 minutos9 de su ingreso a urgencias a menos que sea posible realizar ICP por personal experimentado en un lapso óptimo.75 En más de 300,000 pacientes80–105 la TF asociada a heparina no fraccionada y ácido acetilsalicílico (AAS) ha demostrado en la fase aguda y a 30 días reducir mortalidad y eventos adversos. Estos resultados se han sostenido con fibrinolíticos de 1ª, 2ª y 3ª generación,80,86,91,94,99,101,102 con regímenes estándar, acelerados o bolos59,80,86,91,94,99,101,102 y con diferentes tratamientos adjuntos.59,80,102–105 Estudios de seguimiento y meta–análisis sugieren que el beneficio de la fase aguda podría extenderse más allá de la hospitalización.95–97
El beneficio máximo se obtiene entre las 0 a 2.5 horas del inicio de los síntomas y se expresa por 34 sobrevivientes/1,000 tratados/hora con tratamiento temprano.106 El grupo que recibe TF en las primeras 2 horas obtiene el mayor beneficio en términos de eventos adversos y mortalidad en comparación con > 2 horas (20% versus 44%, p = 0.001). Estos resultados demuestran que la relación entre el retardo en el tratamiento y reducción absoluta de mortalidad, se describe mejor por una ecuación de regresión no–linear que por una linear y establece bases suficientes para entender el concepto de la "hora dorada". En presencia de BRIHH también se observó una significativa reducción de la mortalidad absoluta (30/1,000) dentro de las primeras 6 horas del inicio de los síntomas.107 Esto implica establecer programas en los servicios de urgencias con personal médico y paramédico para iniciar reperfusión farmacológica en < 30 minutos de su ingreso (Tabla X).

C) Subgrupos especiales
En la Tabla XI se resumen los diferentes niveles de indicación y evidencia de los subgrupos especiales en los cuales se utiliza la terapia fibrinolítica.

1. Terapia fibrinolítica tardía: (> 6 horas de inicio de los síntomas)
Nivel de evidencia IIb B
Después de 4 horas de isquemia sostenida se establece necrosis y daño miocárdico irreversible, no obstante, la TF tardía a través de algunos mecanismos podría disminuir mortalidad cardiovascular en IMEST sin disfunción ventricular.97,106 Esta evidencia se desprende de tres estudios multicéntricos realizados a principio de la década de los años noventa.95,96,108 En el estudio EMERAS95 en términos de mortalidad no se observó ningún beneficio en los que recibieron TF tardía. En el LATE96 los que recibieron TF entre 6 y 12 horas del inicio de los síntomas tuvieron mejor sobrevida a 35 días (8.9% vs 12%, p = 0.02). Este beneficio estuvo directamente relacionado con mayor porcentaje de hemorrágica cerebral, sin embargo, a 6 meses no se observó ninguna diferencia en sobrevida y eventos adversos. En el estudio TAMI–6 los que recibieron TF (6 y 24 horas) tuvieron mayor recanalización de la arteria responsable del infarto (65% vs 27%) y a 6 meses se observó menor remodelación ventricular.108 El beneficio de la TF dentro de las primeras 12 horas también parece extenderse al grupo con BRIHH por una sobrevida aproximada de 20/1,000 pacientes.97
En nuestro medio sólo un estudio demostró resultados similares, sin embargo, algunas limitaciones como muestra reducida, ausencia de angiografía coronaria y la inclusión de infartos no extensos, impidió establecer si el beneficio se podía atribuir a la TF tardía o a otros mecanismos como recanalización por lisis endógena, enfermedad coronaria no–crítica, etcétera.109 Todos estos datos sugieren que la TF > 12 horas no ofrece ningún beneficio y aunque no existe suficiente evidencia para extender esta terapéutica entre 6 y 12 horas, algún grupo se podría beneficiar a través de mecanismos que atenúan la isquemia (miocardio preacondicionado o circulación colateral). Al no existir una forma objetiva para estratificar este grupo, es muy difícil identificar pacientes que pudieran beneficiarse y no conocemos el riesgo/beneficio que implica este proceso.106
2. Terapia fibrinolítica prehospitalaria
Nivel de evidencia IB
Estudios multicéntricos han demostrado factibilidad, seguridad y significativa reducción en el tiempo (2 horas en domicilio y 1 hora en unidades médicas) de inicio. En relación con la TF convencional, la prehospitalaria demostró en un meta–análisis disminución temprana de la mortalidad (17%) y 18 vidas salvadas por 1,000 pacientes tratados.112–114 Esta proporción entre la duración de los síntomas y la evolución clínica derivan de estudios que han analizado el retraso en el tratamiento y su relación con el tamaño del infarto.115 Al evaluar el área de miocardio en riesgo mediante el ST en un primer infarto (< 6 horas) y comparar el tamaño final con medicina nuclear, se demostró que por cada 30 minutos de retraso existe un incremento del 1% en el área del infarto. Después de 4 horas no hubo diferencia en la extensión del infarto entre los que recibieron onoTF.116
3. Choque cardiogénico
Nivel de evidencia IIb B
Es indicación absoluta para ICP ya que la TF no ha demostrado efectividad.121,122 En el estudio GIS SI–I81 los que recibieron estreptoquinasa tuvieron un porcentaje alto de mortalidad y no se observó diferencia con el grupo control (70.1% versus 69.9%). En el estudio FTT 97a 35 días, los que recibieron TF con tensión arterial (TA) diastólica < 100 mm Hg y frecuencia cardíaca > 100/ minutos, tuvieron menor mortalidad que el control (54% versus 61%). Esta diferencia no fue estadísticamente significativa. El HERO es el único estudio contemporáneo que incluyó disfunción ventricular grave,104 pero por el porcentaje reducido de pacientes (KK III 5% y KKIV 3%) no es posible establecer ninguna dirección terapéutica objetiva.
Aunque los datos son limitados, en este grupo parece existir algún beneficio con agentes no–fibrino específicos. En los estudios GISSI–223 y GUSTO–I94 se observó menor mortalidad en los que recibieron estreptoquinasa en relación a alteplasa. Aunque la explicación no es clara, algunos datos experimentales sugieren que los fibrino específicos requieren de perfusión coronaria normal para lograr la disolución del trombo, mientras que los agentes no–fibrino específicos al establecer un estado lítico sistémico pueden inducir lisis del trombo aun en presencia de hipotensión. Otra explicación podría ser la baja viscosidad de la sangre generada por la estreptoquinasa al consumir fibrinógeno en forma masiva.
En conclusión, pacientes con alta sospecha de choque cardiogénico deben llevarse a ICP si el procedimiento se realiza por un grupo con experiencia y sin retardo. En caso contrario y aunque la evidencia no es fuerte, se debe iniciar TF si se encuentra dentro de las primeras 6 horas del inicio de los síntomas y sin contraindicaciones absolutas.
4. Terapia fibrinolítica de rescate y refibrinólisis
Nivel de evidencia IB
Aunque estos términos no se han definido adecuadamente en la literatura,123–129 la TF de rescate se aplica cuando se utiliza un segundo régimen fibrinolítico por persistencia del dolor y de la elevación del ST. El término refibrinólisis podría utilizarse cuando después de un primer procedimiento con éxito, por nuevo episodio de dolor y elevación del ST se vuelve a utilizar el mismo u otro régimen fibrinolítico.130 Aunque algunos autores consideran un segundo régimen fibrinolítico como opción a la falla de la TF,123,129 si existe fracaso terapéutico la alternativa lógica es una ICP de rescate. En la Figura 6 se observan algunas direcciones para estratificar al paciente después del empleo de TF. En este escenario dos aspectos son fundamentales: 1) reconocer el fracaso terapéutico y 2) la elección del manejo apropiado.123129131 Para esto es fundamental analizar el comportamiento del dolor y del ST, si hay signos de reperfusión se debe iniciar un tratamiento antitrombótico y antiisquémico efectivo. Si hay persistencia o incremento del dolor o del ST asociado a datos de inestabilidad clínica (disfunción ventricular) o se considera que la inestabilidad es inminente (TA normal, perfusión sistémica normal o compensada, hipoquinesia global del ventrículo izquierdo y fracción de expulsión < 40%),132 debe considerarse una angiografía urgente. Si no hay accesibilidad a un laboratorio de hemodinamia, podría considerarse la posibilidad de utilizar TF de rescate. En caso de estabilidad clínica debe evaluarse la localization, el área de miocardio en riesgo y el tiempo de isquemia (Fig. 6).
El beneficio de un segundo régimen fibrinolítico podría limitarse por el riesgo de una hemorragia mayor y confinarse a aquéllos en los que no se logra un estado lítico ideal (fibrinógeno > 1 g/L).123 En nuestro medio, pacientes con infarto, inestabilidad clínica e inaccesibilidad para ICP fueron llevados a una segunda dosis de estreptoquinasa por isquemia persistente o reoclusión temprana con lo que se limitó el tiempo de isquemia y la extensión del infarto.124
Una revisión sistematizada de la literatura para conocer el nivel de evidencia de la TF de rescate o refibrinólisis identificó 195 pacientes (MEDLINE 1980–2003) en 13 estudios con criterios de ingreso previamente definidos. Sólo cuatro tuvieron un poder aleatorio bajo y el resto fueron series y reportes de casos. Alteplasa asociado a tratamiento adjunto convencional fue el segundo régimen fibrinolítico más utilizado. Se indicó en jóvenes (edad 57.33) y no hay datos con heparinas de bajo peso molecular, (HBPM) inhibidores de los receptores de glucoproteínas IIb/IIIa (IGIIb/IIIa) y fibrinolíticos de tercera generación. El porcentaje de hemorragia intracraneal fue del 0.5% con mortalidad hospitalaria del 5.6% y cardiovascular del 7%.132 Aunque la TF de rescate y la refibrinólisis han sido consideradas alternativa terapéutica123,129 y la incidencia de hemorragia intracraneal es baja, el nivel de evidencia se limita a reporte de casos y estudios con bajo poder estadístico, esto implica que podría aceptarse su uso en jóvenes con bajo riesgo para complicaciones hemorrágicas, inestabilidad clínica e inaccesibilidad a ICP. Desconocemos la seguridad en términos de hemorragia mayor con ICP, antitrombóticos modernos y fibrinolíticos de tercera generación.
5. Mayores de 75 años
Nivel de evidencia IIa B
Desde el inicio de la reperfusión farmacológica los grandes estudios multicéntricos históricamente han excluido > 75 años de edad, por la relación directa con TF y hemorragia vascular cerebral.71,109,133 A pesar de la alta mortalidad demostrada con tratamiento convencional un grupo muy reducido recibe TF. En el estudio ISIS–2 la reperfusión farmacológica en > 80 años disminuyó la mortalidad de un 37% a un 20%, lo que representó una supervivencia de aproximadamente 17 pacientes > 75 años/100 pacientes.59 En nuestro medio, también se observó menor índice de mortalidad, reinfarto, ruptura cardíaca, isquemia postinfarto o muerte súbita.109 En estos pacientes es importante identificar un perfil clínico que facilite la decisión: a) superficie corporal óptima, b) estado biopsíquico satisfactorio, c) entorno socioeconómico apropiado y d) sin contraindicaciones absolutas. Además, el estudio FTT establece que "claramente, que la sola edad no debe considerarse como contraindicación para TF".97 Sin embargo, en > 75 años (especialmente sexo femenino) existe mayor incidencia de enfermedad vascular cerebral hemorrágica en relación a grupos de menor edad. En el estudio GUSTO V se observó mayor incidencia de eventos adversos al asociar abciximab, heparina no fraccionada y media dosis de tenecteplasa.134
En > 75 años la TF se debe utilizar después de una cuidadosa selección para identificar el riesgo entre una hemorragia intracraneal y mayor mortalidad con tratamiento convencional. El régimen fibrinolítico recomendado es la estreptoquinasa en infusión y dosis convencionales debido a menor incidencia de enfermedad hemorrágica vascular cerebral.109
6. Descontrol hipertensivo
Nivel de evidencia IIb B
Historia de hipertensión y descontrol hipertensivo (diastólico o sistólico) son variables estrechamente relacionadas con complicaciones hemorrágicas, especialmente en el sistema nervioso central. En el estudio GUSTO I una TA > 180 mm Hg sin respuesta a tratamiento fue considerado como contraindicación relativa y la decisión para ingresar al estudio quedó a discreción del investigador. Los resultados sugieren que en IMEST y descontrol hipertensivo sistólico el riesgo de mortalidad es similar al de pacientes con T A normal. El riesgo de hemorragia intracraneal incrementó en forma proporcional con TA sistólica elevada y con cifras > 175 mm Hg la incidencia fue doble (1.71%) de lo observado con TA normal. Además, la historia de hipertensión identifica un grupo de alto riesgo por edad, sexo femenino, mayor incidencia de diabetes, disfunción ventricular y mala evolución, (muerte y hemorragia mayor).94
El riesgo de hemorragia intracraneal con alteplasa se ha relacionado con hipertensión sistólica, edad y dosificación por kilogramo de peso corporal.135 En nuestro medio, la presencia de hipertensión sistólica sin control al ingreso (175.83 ± 9.96) también fue un indicador de riesgo para hemorrágica vascular cerebral y mortalidad.136 En este grupo el empleo de metoprolol por vía endovenosa u oral parece ofrecer un efecto protector al disminuir la intensidad de la onda del pulso sobre la pared arterial de los vasos cerebrales y obtener mejor control de la TA.89 Aunque esto no ha sido bien determinado, tiempos de tromboplastina parcial activa por arriba del rango terapéutico pudieran contribuir en forma importante a la incidencia de hemorragia cerebral, aun en ausencia de hipertensión y enfermedad cerebrovascular previa.138 Pocos estudios han analizado los niveles tromboplastina parcial post–TF, dosis de heparina, y la interacción del tratamiento antitrombótico adjunto, por lo que en la génesis de la hemorragia intracraneal, aunque su participación no se encuentra bien determinada, debe ser fuertemente considerada. En nuestro medio, > 75 años con IMEST y urgencia hipertensiva (TA sistólica 181 ± 20.9 y/o diastólica 117.5 ± 10.4) al controlar la TA recibieron el régimen estándar de estreptoquinasa. En ningún caso se observó hemorragia intracraneal y el único aspecto relevante fue un retardo en la administración de la TF en relación con su ingreso (41.25 ± 19 minutos).109,139 En el momento actual, el antecedente de hipertensión sistólica en presencia o no de un descontrol hipertensivo constituye un marcador clínico de alto riesgo para enfermedad hemorrágica cerebrovascular y no depende únicamente de la elevación súbita de la TA, ya que puede existir enfermedad cerebrovascular difusa o regional con mayor remodelación vascular secundaria a hipertensión y edad.138,139 Aunque desconocemos si al ingreso, el tratamiento agudo del descontrol hipertensivo reduce el riesgo de hemorragia intracraneal, los fibrinolíticos de primera generación podrían ser una alternativa.
7. Terapia fibrinolítica facilitada
Nivel de evidencia IIb A
Recientemente se ha considerado la posibilidad de romper los límites de la reperfusión farmacológica140 al intentar inhibir en forma directa la vía final de la actividad plaquetaria a través de los IGPIIb/IIIa para disminuir retrombosis, índice de reoclusión y mejorar el porcentaje de flujo TIMI III.141 Por otra parte, la mitad de la dosis de un régimen fibrinolítico estándar podría disminuir la incidencia de complicaciones hemorrágicas.139 Los IGPIIb/IIIa podrían facilitar la fibrinólisis y mejorar la perfusión tisular a través de los siguientes mecanismos: a) al bloquear aproximadamente el 80% de los receptores de superficie plaquetaria, se evita la agregación plaquetaria y se reduce el tamaño del trombo (fundamental para la generación de trombina); b) inhiben la liberación de granulos plaquetarios densos y alfa, disminuyendo la concentración de los inhibidores del activador tisular del plasminógeno tipo 1 y plasmático alfa 2; c) debilitan la estructura del trombo al bloquear la unión del factor XIII con las plaquetas y disminuyen los enlaces cruzados de las bandas de fibrina y del inhibidor plasmático alfa 2 con la fibrina; y d) al reducir el crecimiento e incrementar la porosidad del trombo, atenúan la retracción de la porción plaquetaria, facilitando la penetración del fibrinolítico.139
Todos los estudios de fase II que han analizado la utilidad de combinar un fibrinolítico (dosis completa o reducida) con un IGPIIb/IIIa, han demostrado angiográficamente mejor permeabilidad y mejor perfusión subendocárdica. (resolución más rápida del ST). Sin embargo, la incidencia alta de complicaciones hemorrágicas y trombocitopenia disminuyó el impacto de estos resultados.141–147
A diferencia de lo observado en fase II, las investigaciones clínicas de fase III que evaluaron el sinergismo entre reteplasa134 o tenecteplasa103 con un IGPIIb/IIIa, muestran inconsistencias en sus resultados. El GUSTO V134 analizó la mortalidad a 30 días entre el régimen estándar de reteplasa versus la mitad de la dosis del fibrinolítico más dosis estándar de abxicimab. Todos recibieron AAS con una dosis de heparina no fraccionada ajustada al peso (bolo 60 U/kg máximo 4,000 U, infusión de 12u/kg máximo 1,000 U/ hora con TTPa de 50 a 70 segundos) La mortalidad en ambos grupos (5.9% vs 5.6%, p = NS) sugirió no–inferioridad de la combinación de reteplasa más abxicimab en comparación con reteplasa sola. Al igual que en los estudios de fase II, la incidencia de complicaciones hemorrágicas, incluyendo hemorragia no–intracraneal moderada o grave, fue mayor para reteplasa más abxicimab que para el régimen de reteplasa estándar (24.6% vs 13.7%, p < 0.001). Esta tendencia fue similar para trombocitopenia (2.9% vs 0.7%, p < 0.001) y transfusiones (5.7% vs 4.0%, p < 0.001). Además, se realizó intervención coronaria percutánea y cirugía de revascularización dentro de las primeras 6 horas ó 7 días en el 40.3% del grupo reteplasa más abxicimab y en el 34.1% del grupo reteplasa.71
El estudio ASSENT–3 se diseñó para probar el sinergismo entre tenecteplasa (dosis ajustada al peso corporal) y tres antitrombóticos con mecanismos únicos y específicos sobre componentes del trombo y su relación con mortalidad a 30 días. Todos recibieron AAS y los tres grupos de tratamiento incluyeron dosis completa de tenecteplasa con enoxaparina o heparina no fraccionada (dosis baja) y la mitad de la dosis del fibrinolítico con dosis estándar de abxicimab. A 30 días la mortalidad con tenecteplasa más enoxaparina fue de 5.4%, –la mortalidad más baja observada en la historia de la TF– para tenecteplasa y heparina no fraccionada de 6% y para la mitad del fibrinolítico con abciximab 7% (p = NS). La incidencia de hemorragia no–cerebrales (p = 0.0002), transfusiones (p = 0.001) y trombocitopenia (p = 0.0001) fue mayor para la TF facilitada en relación al régimen estándar del fibrinolítico y heparina no fraccionada. Esta tendencia fue similar en > 75 años diabéticos en donde se observó un incremento tres veces mayor para complicaciones hemorrágicas. Es importante enfatizar que en todos los grupos existió en la fase hospitalaria un alto porcentaje de ICP o revascularización quirúrgica (enoxaparina 32.5%, abciximab 32.1% y heparina no fraccionada 35.3%). El grupo tenecteplasa y heparina no fraccionada tuvo el mayor porcentaje de angioplastía urgente (14.4%, p < 0.0001).71
Con toda la evidencia anterior es posible identificar que en pacientes con infarto el debate continúa en relación a establecer si un régimen fibrinolítico combinado con IGPIIb/IIIa ofrece un beneficio adicional a la reperfusión miocárdica óptima. En México los únicos datos disponibles emanan del estudio SASTRE el cual analizó en 144 pacientes con un primer infarto dentro de las primeras 6 horas del inicio de los síntomas, la efectividad sobre la reperfusión epicárdica entre alteplasa en dosis reducida (50 mg) más tirofibán versus intervención coronaria y este IGPIIb/IIIa. La dosis de tirofibán utilizada fue de un bolo de 4 ug/kg/min/30 min seguido de una infusión de 0.1 ug/kg/minuto. Un grupo control recibió dosis completa de alteplasa (100 mg en una hora) y todos fueron llevados a angiografía coronaria a los 90 minutos. El objetivo primario fue un flujo TIMI III a los 90 minutos, el secundario, analizar perfusión miocárdica y el compuesto, eventos adversos a 30 días (mortalidad, reinfarto, isquemia refractaria, AVC, insuficiencia cardíaca, revascularización y edema pulmonar). En los dos grupos que incluyeron tirofibán se observó el mejor flujo TIMIIII, para alteplasa más IGPIIb/IIIa fue de 64% en comparación a un 42% para alteplasa sola. En la ICP más tirofibán el TIMI fue de 92% versus 81% cuando solo realizó la reperfusión mecánica. La mayor incidencia de eventos adversos combinados fue para las dos estrategias de reperfusión estándar. La mejor evolución se observó cuando se obtuvo perfusión epicárdica y subendocárdica. La incidencia de complicaciones hemorrágicas fue similar para ambos grupos (2.8%).
Todo lo anterior sugiere que la TF facilitada sobre la macro y microcirculación disminuye eventos adversos, (isquemia recurrente o reinfarto) sin mejorar mortalidad. Esto se logró a expensas de un alto índice de procedimientos de revascularización coronaria, complicaciones hemorrágicas y trombocitopenia. Paradójicamente la combinación entre IGPIIb/IIIa y revascularización coronaria percutánea a 30 días disminuyó isquemia recurrente y mortalidad. Lo que apoya que la mayor efectividad de estos inhibidores se logra durante un estadio de grave disfunción endotelial y trombosis aguda (alta actividad plaquetaria) generado por la revascularización mecánica. La inconsistencia de los IGPIIb/IIIa en estudios de fase III en IMEST y en SCA de alto riesgo sin elevación del ST67 podría atribuirse a baja inhibición plaquetaria en ausencia de revascularización temprana y posibles mecanismos paradójicos protrombóticos y proinflamatorios inducidos por CD40L, activación endotelial y plaquetaria y agregación de leucocitos y plaquetas.71
8. Revascularización coronaria previa
Nivel de evidencia IIb B
En el momento actual no existe evidencia que demuestre que el antecedente de una revascularización coronaria sea un criterio de exclusión. Por otra parte, este grupo no ha sido incluido en estudios multicéntricos por la dificultad que existe para identificar electrocardiográficamente la arteria relacionada con el infarto. En el 80% el mecanismo del infarto en el injerto aorto–coronario es una obstrucción crítica y en el 20% restante el fenómeno de aterotrombosis se localiza en una arteria coronaria nativa.148 En el estudio GUSTO–P4 este antecedente fue variable clínica independiente de mortalidad a 30 días y se asoció con enfermedad extensa y disfunción ventricular. La percepción de una menor respuesta a la TF se ha atribuido a trombos grandes en la derivación aorto–coronaria lo que podría explicar que los mejores resultados se podrían obtener con fibrinolíticos potentes como alteplasa.94 Aunque con la TF se ha demostrado éxito y baja incidencia de complicaciones, la evidencia es limitada,109,149,150 por lo que no es posible establecer su efectividad. Sin embargo, esto no excluye que se utilice durante un IMEST en el intento de preservar viabilidad miocárdica, sostener función ventricular y disminuir la mortalidad.109
9. Infarto previo
Nivel de evidencia IIb A
La mayoría de los estudios multicéntricos internacionales han excluido a este grupo, por lo que la evidencia es limitada. No obstante, un nuevo IMEST puede ser expresión de viabilidad miocárdica residual, representa una nueva área de miocardio en riesgo y mayor detrimento de una fracción de expulsión posiblemente ya deteriorada. En el estudio GIS SI80 al comparar pacientes con infarto previo con o sin TF, no se logró disminuir la mortalidad (16.9% vs 16.5%, p = NS). En el estudio ISAM,82 el grupo con infarto previo y nuevo infarto anterior que recibió TF, tuvo mayor mortalidad en el seguimiento que en el grupo control (52.8% vs 31%, p < 0.03).82 Sin embargo, en pacientes con similares características en los estudios ISIS–259 y holandés151,152 la TF disminuyó significativamente la mortalidad. Esto sugiere que en este grupo de alto riesgo para choque cardiogénico y ruptura cardíaca, la TF puede disminuir mortalidad. Esta terapéutica debe contemplarse en este grupo cuando no exista accesibilidad a una estrategia de reperfusión mecánica.109
10. Diabetes mellitus
Nivel de evidencia I A
A pesar de que la diabetes es una variable independiente de mortalidad, en este grupo la TF se encuentra subutilizada por la percepción de mayor incidencia de complicaciones hemorrágicas y porque la sistematización del dolor es difícil. En el estudio FTT97el índice de hemorragias mayores incluyendo intracraneal fue ligeramente mayor y en el GIS S1–2 no existió diferencia alguna entre diabéticos y no diabéticos.92 En relación con su efectividad, aunque la reducción proporcional y absoluta de la mortalidad fue discretamente menor no existió diferencia significativa.97 Por otra parte, el subestudio angiográfico del GUSTO I demostró que la TF es igualmente eficaz para restaurar la permeabilidad de la arteria culpable en pacientes con y sin diabetes.153 Aun después de ajustar variables clínicas y angiográficas y a pesar de la TF, la diabetes se sostiene como una variable independiente de mortalidad alta temprana. En las zonas libres de infarto un mayor porcentaje de reoclusión y de isquemia a distancia parecen contribuir a una mayor prevalencia de insuficiencia cardíaca y mortalidad.153 En conclusión, los pacientes diabéticos con IMEST son tan buenos candidatos para TF como los no diabéticos. No hay evidencia que demuestre que el riesgo de hemorragia sea mayor en este grupo, sin embargo, a pesar de una efectiva reperfusión farmacológica este grupo tiene mal pronóstico.
11. Infarto sin elevación del ST
Nivel de evidencia IIb B
Aunque los resultados del estudio TIMI–IIIB154 sugieren que una dosis reducida de alteplasa incrementó la mortalidad en pacientes con SCA sin elevación del ST, no se consideraron variables que pudieron sobre o subvaluar resultados y no se estableció un grupo de riesgo que pudiera beneficiarse (disfunción ventricular, fracaso terapéutico, etcétera).155 Al comparar mortalidad a un año entre el grupo que recibió alteplasa o placebo, no existió diferencia estadísticamente significativa.156
Un subanálisis del estudio LATE157 sugiere que la TF en infarto sin elevación del ST establece un mejor pronóstico que los que reciben tratamiento convencional. Al comparar SCA con y sin elevación del ST se demostró en éstos menor mortalidad a 35 (p = 0.001) y 360 días (p = 0.001). También se observó en el grupo con alteplasa menor índice de reinfarto (p = 0.0009) y mortalidad cardiovascular (p = 0.008). A un año, el porcentaje de reinfarto (p = 0.002) y mortalidad (p = 0.004) también fue menor en el grupo sin elevación del ST y TF. En la fase aguda y a un año de seguimiento no se observó en ningún grupo diferencia estadísticamente significativa en relación al tiempo desde el inicio de los síntomas, iniciación del tratamiento, niveles máximos de CPK y procedimientos de revascularización coronaria. Los pacientes con infarto sin elevación del ST en comparación con IMEST tuvieron mayor edad, isquemia recurrente, infartos previos e inestabilidad hemodinámica. Los resultados sugieren que en infarto sin elevación del ST llevados a alteplasa tienen mejor pronóstico a 35 días y a un año.
Sobre la base de la evidencia demostrada por el estudio TIMI–IIIB, los datos a favor o en contra para utilizar TF en infarto sin elevación del ST se encuentran limitados por el tamaño de la muestra, (error tipo II) la falta de un diagnóstico preciso, carácter retrospectivo de los estudios y ausencia de una definición apropiada de riesgo alto.154,155 Además, por la falta de marcadores biológicos de micronecrosis durante la fase aguda no fue posible diferenciar un SCA con isquemia prolongada de un infarto sin elevación del ST.15,154 La dificultad se incrementa por la ausencia de criterios electrocardiográficos estandarizados y objetivos de diagnóstico y de reperfusión en este SCA.154 La evidencia sugiere que la TF no incrementa la incidencia de reinfarto ni mortalidad por causa cardiovascular o no cardiovascular, por lo que su empleo podría considerarse en pacientes con perfil de riesgo alto: a) isquemia aguda de reposo > 20 minutos, b) desnivel negativo del ST, c) área extensa de miocardio en riesgo (ECG o ecocardiograma), d) signos de inestabilidad clínica (disfunción del ventrículo izquierdo, bajo gasto cardíaco, etcétera, e) datos ecocardiográficos de inestabilidad inminente (fracción de expulsión < 35%, hipoquinesia global del ventrículo izquierdo, con o sin datos de isquemia a distancia, f) mala respuesta a tratamiento farmacológico máximo, y g) inaccesibilidad a coronariografía de diagnóstico.155
Un aspecto fundamental a considerar, es que en ninguno de los estudios previos154–157 se utilizaron marcadores bioquímicos de necrosis celular, como troponina o mioglobina, por lo que no conocemos si la TF se sub o sobre utilizó, en grupos de bajo o alto riesgo. En el momento actual, y de acuerdo a las conclusiones de hace 12 años del estudio TIMIIIIB,154 no se recomienda utilizar TF en este grupo de enfermos, sin embargo, por lo mencionado previamente, estos resultados deben reconsiderarse. Se requieren estudios controlados, multicéntricos con muestra estadísticamente significativa que incluyan marcadores de daño celular agudo y nuevos antitrombóticos para conocer la seguridad y efectividad de la TF en este grupo.158
12. Reanimación cardiopulmonar reciente
Nivel de evidencia IIb B
No es contraindicación a menos que se prolongue (> 10 minutos) o exista trauma torácico importante.109 Cuando el lapso es mayor la incidencia de fracturas de arcos costales y/o de esternón es de un 30% a un 45% respectivamente.159 En pacientes con reanimación cardiopulmonar < 10 minutos, el grado de complicaciones hemorrágicas no fue diferente a aquéllos en los que no se realizó este procedimiento.160 Aunque la mortalidad es alta, la TF después de una reanimación cardiopulmonar con éxito, no ha demostrado mayor incidencia de hemotórax o hemopericardio.161 Cuando el procedimiento no rebasa los 25 minutos la seguridad parece ser adecuada.162,163 Después de un episodio de fibrilación ventricular la incidencia de hemorragia mayor es muy reducida, ya que esta arritmia por lo general se presenta bajo observación por lo que el tiempo de compresión torácica es reducido.109 Sobre la base de los datos mencionados, la decisión para iniciar TF después de una reanimación cardiopulmonar no depende únicamente de la duración, sino de una evaluación clínica estricta en el intento de identificar un traumatismo torácico importante y excluir daño irreversible del sistema nervioso central.
D) El electrocardiograma en el proceso de la terapia fibrinolítica
Este método no invasivo, de bajo costo y accesible ha soportado el paso del tiempo y en el IMEST se mantiene como elemento importante para el diagnóstico, estratificación, selección de tratamiento y evaluación de lamicrocirculación. Un análisis cuantitativo y cualitativo del comportamiento del ST además de identificar en forma temprana y acuciosa el territorio de la arteria relacionada con el infarto, permite reconocer el área de miocardio en riesgo y tomar la decisión de una revascularización urgente (Fig. 6).
Además de un infarto agudo, el segmento ST puede elevarse por variantes normales, BRIHH, pericarditis, hipertrofia del ventrículo izquierdo, miocarditis, hiperkalemia, síndrome de Bragada, tromboembolia pulmonar y cardioversión. Un análisis cuidadoso asociado al juicio clínico permite diferenciar padecimientos que simulan un infarto agudo.164
1. Criterios electrocardiográficos de infarto y BRIHH:
En el escenario de un IMEST un BRIHH debe considerase como marcador de mal pronóstico por su asociación con mala fracción de expulsión, complicaciones cardiovasculares, necrosis miocárdica extensa e infarto previo. Además, sugiere oclusión proximal de la descendente anterior y un área importante de miocardio en riesgo.97165 Sin embargo, a pesar de que la TF ha demostrado mejorar la evolución en este grupo de riesgo alto, por la dificultad del diagnóstico electrocardiográfico rara vez se recibe este beneficio.97 Los investigadores del estudio GUSTO–I identificaron los siguientes criterios electrocardiográfcos que incrementan significativamente la probabilidad de infarto en presencia de BRI–HH: a) elevación del ST > 1 mm en la misma dirección del complejo QRS, b) desnivel negativo del ST > 1 mm en VI, V2 y V3 y c) elevación del ST > 5 mm en dirección opuesta al complejo QRS.98 En México, Sodi Pallares y colaboradores propusieron otros criterios como: a) complejo RS con onda T negativa en V5 y V6, b) onda q (complejo qRs) en V5 y V6, c) complejo qrS en V5 y V6 y d) complejo qrS con bajo voltaje en V5 y V6.166
2. Sospecha de infarto con electrocardiograma normal o inespecífico:
En presencia de electrocardiograma normal o inespecífico (sobrecarga sistólica y/o hipertrofia del ventrículo izquierdo, ritmo de marcapaso, isquemia o desnivel negativo del ST), como expresión de un estadio temprano de isquemia se ha considerado la posibilidad de utilizar TF, para tratar de limitar la extensión de la necrosis. Sin embargo, en la mayoría de estos casos la decisión terapéutica se retrasa en espera de la evolución electrocardiográfica y/o de obtener un marcador bioquímico de daño celular agudo, lo que produce un mayor tiempo de isquemia del miocardio en riesgo.
Al correlacionar la elevación del ST con hallazgos angiográficos en pacientes con IMEST, se ha demostrado baja sensibilidad para demostrar infarto agudo. La elevación del ST se observó únicamente en el 48% de los pacientes con enfermedad de la circunfleja, en el 71% de los enfermos con participación de la coronaria derecha y en el 72% de aquéllos con afección de la descendente anterior. Esto sugiere que la elevación del ST puede estar ausente en un número importante de pacientes con infarto agudo, por lo que la falta de este criterio universal de inclusión excluye un número importante que pudiera beneficiarse.133 La principal razón para no utilizar TF en este grupo, es la posibilidad de cometer un error diagnóstico con padecimientos que pueden simular infarto agudo como pericarditis, disección aórtica, tromboembolia pulmonar, pancreatitis, enfermedad péptica activa, etcétera. En este escenario, un ecocardiograma podría identificar en forma temprana trastornos de movilidad, además de excluir padecimientos que simulan IMEST. Las alteraciones regionales pueden observarse durante los primeros segundos de una oclusión coronaria y anteceden a las manifestaciones electrocardiográficas y clínicas de isquemia aguda.133 Este estudio no invasivo demuestra en forma objetiva la presencia de hipoquinesia segmentaria o global del ventrículo izquierdo, la fracción de expulsión, extensión del área de miocardio en riesgo, regiones con isquemia a distancia y complicaciones mecánicas. También indica en forma indirecta viabilidad pre TF por el engrosamiento normal del endocardio y post por una fracción de expulsión conservada. La principal limitación del ecocardiograma es su falta de accesibilidad en la mayor parte de los servicios de urgencias.132
E) Criterios de reperfusión
Los indicadores con los que contamos actualmente para evaluar el éxito o fracaso de la TF son el comportamiento del dolor torácico, la resolución temprana del ST, arritmias postreperfusión y marcadores bioquímicos de daño celular agudo.
Dolor torácico
La reducción significativa del dolor torácico típicamente comienza dentro de los primeros 51 ± 20 minutos y coincide con otros signos de reperfusión como regresión temprana del ST.168 La disminución del dolor se ha asociado con demostración angiográfica de reperfusión (TIMI 3). La recurrencia del dolor y nueva elevación del ST deben considerarse como índices de reoclusión. Se sugiere que el incremento transitorio de la intensidad podría considerarse como reperfusión inminente y expresión de daño por reperfusión.129 El inconveniente de este criterio es que no puede aplicarse a todo IMEST ya que un número importante cursa sin dolor o con equivalentes. Este grupo tiene baja probabilidad de ser considerado para TF o ICP e incluye diabéticos, sexo femenino, > 75 años, historia de insuficiencia cardíaca o accidente cerebrovascular, ciertos grupos raciales, edema agudo pulmonar e ingesta excesiva de alcohol. Cuando no existe reperfusión, la mejoría del ST se observa después de dos horas de iniciado el tratamiento.168 Para valorar el dolor como criterio de reperfusión se debe prescindir de analgésicos. Sin embargo, ciertas condiciones clínicas, no permiten esta conducta, como dolor intenso e incoercible o cuando el paciente es considerado para ICP. Podría ser de utilidad no usar analgésicos cuando se decide TF y el dolor es tolerable con un comportamiento decreciente a partir de la infusión. Su desaparición o mejoría (> 70%) en un lapso de 100 minutos desde el inicio de TF asociado a mejoría temprana del ST sugieren reperfusión.168
Resolución del ST
Observaciones clínicas posteriores a la era de la TF establecen la necesidad de monitorizar el comportamiento del ST y la resolución temprana como variable de alto valor predictivo.129,168–171 Una disminución del ST del 20 al 50% en los primeros 100 minutos correlaciona con flujo TIMI 3 y con alta sensibilidad y especificidad (88 y 80%).168En los que no existió reperfusión angiográfica la regresión del ST se observó tres horas después de iniciada la TF lo que sugiere que los cambios del ST por reperfusión tienen un curso más rápido en comparación a lo observado en la evolución natural. También la inestabilidad y labilidad del ST por recurrencia fue índice de reoclusión temprana y correlacionó con flujo TIMI 0, estenosis residual crítica, pobre circulación colateral, baja fracción de expulsión, y elevación máxima tardía de CK.168 Observaciones recientes confirman el valor predictivo de la persistencia del ST en relación con mortalidad y disfunción ventricular izquierda.171 Al evaluar de esta forma la reperfusión en la macro y microcirculación, es posible en cualquier nivel de atención identificar candidatos para ICP de rescate y establecer el grado de reperfusión en el subendocardio (Fig. 6). La resolución temprana del ST es un excelente marcador de perfusión tisular y sobrevida a corto (30 días) y largo plazo (1 año).129 Para el infarto inferior el umbral óptimo de resolución del ST es > 70% y para los anteriores es > 50%. En términos de pronóstico el mayor grado de resolución se relaciona con menor mortalidad independientemente de la localization.171 Por la rápida acción fibrinolítica del alteplasa la resolución del ST debe esperarse en los primeros 60 a 90 minutos. Por la lenta acción fibrinolítica de la estreptoquinasa, la mejoría del ST como expresión de reperfusión puede observarse entre los 90 y 180 minutos.171 Se debe analizar el comportamiento del ST mediante trazos cada 5 a 10 minutos en la derivación con mayor elevación.168 Si en un infarto inferior disminuye > 70% y en un anterior > 50% se puede considerar reperfusión miocárdica. El tiempo óptimo para la toma de un electrocardiograma depende del fibrinolítico. En caso de alteplasa debe realizarse a los 60 y 90 minutos y si se utilizó estreptoquinasa el ST debe evaluarse a los 90 y 180 minutos. Se deben obtener electrocardiogramas cada 6 u 8 horas durante el primer día para evaluar reoclusión silente.171 En términos generales se puede considerar reperfusión total si existe una disminución del ST > 70%, reperfusión parcial cuando esto se observa entre el 50 y 70% y no–reperfusión o falla terapéutica cuando el ST mejora < 50%.
Arritmias de reperfiisión
En el contexto de un IMEST un fenómeno de reperfusión puede generar una arritmia cardíaca, pero también puede ser expresión de miocardio isquémico. Aunque no existe una definición exacta168 y a diferencia de las arritmias por isquemia con instalación gradual y con menor posibilidad de generar una arritmia ventricular, las arritmias de reperfusión podrían caracterizarse por presentación súbita y mayor incidencia de fibrilación ventricular.168,169 Algunos autores consideran que ocurre segundos después de que se restaura el flujo coronario, cuestionan su génesis y consideran que su incidencia es baja.170 Estas arritmias podrían incluir ritmo idioventricular acelerado, taquicardia ventricular no sostenida, bradicardia y extrasístoles ventriculares frecuentes de uno o varios focos.129 La incidencia del ritmo idioventricular acelerado y de las extrasístoles ventriculares es aproximadamente del 60 al 80%. El ritmo idioventricular acelerado parece ser el fenómeno eléctrico más frecuente, sin embargo, su inespecificidad emerge por falta de correlación con otras variables como elevación máxima de CPK, cambios en el ST y características angiográficas.168169 Aunque las arritmias ventriculares aparecen en forma temprana tiene un límite de tiempo heterogéneo (inicial, 30 minutos, de 50 a 80 minutos, 3.5 a 5.6 horas) en relación al inicio de la TF. En infarto inferior una bradiarritmia asociada a hipotensión, pueden ser un marcador de reperfusión. Sin embargo, en este escenario otras condiciones inherentes podrían explicar esta alteración como isquemia, reoclusión, reflejo de Bezold–Jarish, extensión al ventrículo derecho, hipersensibilidad por el uso de estreptoquinasa o complicación mecánica.168,169 Además durante un IMEST, además de la reperfusión, se pueden generar arritmias por otros mecanismos como isquemia, alteraciones del tono autonómico, inestabilidad hemodinámica y disfunción ventricular.172 Un fenómeno eléctrico aislado difícilmente puede atribuirse a reperfusión, por lo que es necesario analizar estos eventos en forma dinámica y relacionarlos con la resolución temprana o normalización del ST. La presentación debe esperarse en las primeras 4 horas de iniciada la TF, sobre la base de que en este lapso este tratamiento tiene un efecto "antiarrítmico" al reducir extensión, mejorar flujo colateral, producir rápida movilización de productos tóxicos y por consiguiente menor incidencia de arritmias por isquemia. Si en algún momento existiera algún índice de reoclusión (elevación transitoria, persistente, recurrente o sin expresión clínica del ST) o no existiera la resolución requerida del ST, es difícil sostener que se trata de una arritmia por reperfusión.168,169
Marcadores bioquímicos de daño celular agudo Para establecer reperfusión o fracaso de la TF a través de marcadores bioquímicos de daño celular (macro y micronecrosis) se han considerado alternativas que incluyen CK–MB, isoenzimas, troponina cardíaca (T e I) y mioglobina. Todas han demostrado alta sensibilidad y especificidad y cualquiera a los 60 ó 90 minutos posteriores a la TF incrementa significativamente su valor en comparación al basal. Este hallazgo se ha correlacionado con flujo TIMI3 en angiografías realizadas a los 90 minutos.129 No obstante la utilidad de estos hallazgos, ninguna de estas pruebas ha encontrado un lugar en la práctica clínica. Esto podría atribuirse al tiempo tan largo que se requiere para tener disponibles los resultados y a que en la primera hora todos los marcadores pueden ser negativos. El pico máximo de la actividad de la CK total dentro de las primeras 12 horas de iniciada la TF se ha considerado como signo de reperfusión, pero esto se observa tan tardíamente que es difícil establecerlo como expresión de éxito o fracaso.129 Aunque la determinación de micronecrosis (troponinas y mioglobina) pudiera agregar valor a la evaluación bioquímica futura de la reperfusión, su valor en este escenario no queda claro y en México, al igual que en otros países, la determinación cuantitativa se encuentra limitada a centros hospitalarios con tecnología alta.173
Observaciones sugieren que cuando la TF tiene éxito, la elevación máxima de la CPK total se observa en las primeras horas y la CPK–MB tiene un incremento de 2.5 veces en relación al valor basal a los 90 minutos. Las isoenzimas MB2/MB1 tuvieron un comportamiento similar a los 75 minutos y un incremento por lo menos de 3.8 veces a los 120 minutos significó reperfusión. Para la isoforma MM3 una elevación del 50% a los 120 minutos tuvo el mismo significado.168 El incremento de la mioglobina a los 120 minutos (4.6 veces valor basal) se ha relacionado con reperfusión (85 a 90%). Cuando existe fracaso la elevación máxima se identifica hasta 6 horas después. Al analizar la dinámica de la troponina T en IMEST llevados a TF con evaluación angiográfica temprana (45 minutos), se observó en el grupo con TF y reperfusión en las primeras 3.5 horas, mayor flujo colateral y elevación máxima de troponina en las primeras 24 horas (55 veces mayor). En los que la TF se inició entre 3.5 y 6 horas después del inicio de los síntomas, la elevación fue intermedia. No hubo incremento de troponina en ausencia de reperfusión.85 Una estrategia posible en nuestro medio para obtener un análisis más estricto de la curva enzimática, que nos aproxime a un índice de reperfusión más confiable sería determinar CPK y CPK–MB cada hora durante las primeras 4 horas del inicio de la TF y posteriormente cada 4 horas hasta un tiempo máximo de 24 horas. La CPK podría indicar reperfusión cuando una vez iniciada su elevación en la primera hora, se obtuviera a las 10 horas por lo menos un 30% de la curva máxima. Si la elevación de la CPK en la primera hora es menor de la cifra propuesta, es difícil considerar reperfusión. La fracción MB podría indicar reperfusión si en la primera hora se eleva por lo menos del 28% con respecto a la máxima elevación obtenida a los 90 minutos. Si se obtiene una cifra inferior es difícil admitir reperfusión.168
F) Terapia fibrinolítica
En la última década aparecen como alternativas terapéuticas nuevos fibrinolíticos mutantes de alteplasa como reteplasa, lanoteplasa, tenecteplasa y estafiloquinasa recombinada. En nuestro medio contamos además del régimen estándar de estreptoquinasa con dos alternativas, alteplasa y tenecteplasa (Tabla IX).
Régimen fibrinolítico
1. Estreptoquinasa 1,500,000 UI en 60 ó 30 minutos
Nivel de evidencia IA
Esta proteína bacteriana producida por el estreptococo es el prototipo de los llamados no–fibrino específico o fibrinolíticos indirectos, se une al plasminógeno y convierte al plasminógeno en plasmina. Activa tanto la plasmina circulante como la ligada al plasminógeno induciendo un estado de plasminemia sistémica con depleción secundaria del fibrinógeno, plasminógeno y factores V y VIII. Esta "lisis sistémica" crea un estado sostenido de hipocoagulabilidad que puede reducir el riesgo de retrombosis. Los pacientes que reciben estreptoquinasa pueden desarrollar anticuerpos antiestreptoquinasa alcanzando niveles máximos 10 días después de la infusión. Esto se expresa clínicamente por reacciones alérgicas que en las formas leves incluyen eritema cutáneo, escalofríos, etcétera y las graves pueden condicionar un estado de anafilaxia. La liberación de bradicina contribuye a un estado de hipotensión el cual se puede observar al inicio de la infusión o después de las primeras 750,000 UI. Cuando se presenta podría ser útil la posición de Trendelenburg, utilizar soluciones endovenosas, dobutamina en dosis alfa o algún antihistamínico. No se recomienda suspender la infusión ni el empleo de esteroides como profilaxis.174 El régimen estándar de estreptoquinasa disminuyó en forma significativa mortalidad y eventos adversos,59,80–84,87 y por su accesibilidad es el más utilizado a nivel mundial.175 La baja incidencia de complicaciones hemorrágicas lo convierte en el fibrinolítico de elección en grupos de riesgo alto.71,133 Considerando que no existe el fibrinolítico ni el régimen ideal, se ha buscado un equilibrio entre rápida reperfusión, sobrevida y complicaciones hemorrágicas. Al acelerar la infusión de alteplasa a 90 minutos el estudio GUSTO–I, demostró que una reperfusión rápida y temprana se relaciona directamente con una mejor evolución y que, en términos de sobrevida, este régimen fue superior al de estreptoquinasa, pero incrementando la incidencia de complicaciones hemorrágicas.94 Previamente, los estudios GISSI–2 e ISIS–3 no demostraron ninguna diferencia en términos de mortalidad entre ambos regímenes.65,71,92
En nuestro medio al acelerar el régimen estándar de estreptoquinasa a 20 minutos se demostró mejor fracción de expulsión (p 0.001) en comparación con los que recibieron la infusión estándar, sin ninguna diferencia en mortalidad. El perfil clínico de seguridad para evitar un estado de hipotensión con esta infusión incluye: edad < 60 años, peso > 70 kg, TA diastólica entre 80 y 100 mm Hg y no haber recibido vasodilatadores, diuréticos ni analgésicos por vía endovenosa. Este perfil limita el empleo de este régimen a un número reducido de pacientes.71,176
2. Alteplasa 100mg en 90 ó 60 minutos
Nivel de evidencia IA
Es una molécula dominante de cadena única del rt–PA, clonada y producida por tecnología recombinante del DNA. Deriva de una proteasa serina natural fisiológicamente idéntica al activador del plasminógeno endógeno humano y en su estado natural se produce en el endotelio vascular. Es el prototipo de los llamados fibrino específicos o fibrinolíticos directos. Los inhibidores del activador del plasminógeno inhiben su efecto en humanos y no es antigénica por lo que reacciones alérgicas y anafilaxia son poco frecuentes. Su administración rara vez se suspende por hipotensión secundaria y en presencia de cifras de TA en límites inferiores por causa no–cardiogénica (vasodilatadores, hipovolemia, etcétera) es posible iniciar la infusión. Por su mayor especificidad sobre la fibrina induce reperfusión coronaria más temprana con depleción moderada del fibrinógeno, pero la incidencia de hemorragia intracraneal es mayor.92,94 Otra ventaja teórica sobre los no–fibrino específicos es una mayor lisis de la fibrina ligada al trombo.175 La infusión acelerada de Neuhaus en 90 minutos82 cobró popularidad en relación al régimen aprobado por la FDA al salvar 10 de cada 1,000 infartos y prevenir 1 de cada 7 fallecimientos.94 El estudio GUSTO–I94 demostró que un régimen moderno y acelerado de alteplasa es superior a la infusión lenta y antigua de estreptoquinasa por una perfusión temprana, rápida y sostenida de la arteria relacionada con el infarto. Este régimen disminuyó la mortalidad en un 1% en norteamericanos < 60 años, con infarto anterior, en Killip y Kimbal I y dentro de las primeras 4 horas del inicio de los síntomas.133 El mayor porcentaje de re vascularización urgente se realizó en este grupo (9.5% versus 8.5%) lo que pudo incidir en la mortalidad y explicar la inconsistencia observada sobre este mismo objetivo en el resto de los países participantes.133,178–181 No obstante, el GUSTO–I probó que una infusión acelerada es mejor que una infusión estándar y que acelerar la infusión de otros regímenes podría ser una estrategia alterna de reperfusión. También estableció que posiblemente aún no se ha dicho la última palabra en relación a cuál es el mejor régimen fibrinolítico.133Un estudio alemán angiográfico de fase II demostró que con una infusión de alteplasa en 60 minutos es posible obtener flujo TIMIIII mayor del 80%.182 Previamente un estudio cooperativo realizado en nuestro medio con este mismo régimen demostró reperfusión en el 80%, complicaciones hemorrágicas en un 8% y a 30 días una sobrevida del 95%.183 Estos resultados permiten establecer a este régimen como la alternativa lógica en México. Ambos estudios establecieron la seguridad y efectividad del régimen de alteplasa en 60 minutos y simplificaron la infusión de 90 minutos (Tabla IX).
3. Tenecteplasa bolo único de 5 a 10 segundos en dosis por kilogramo de peso
Nivel de evidencia IA
Es similar a la forma nativa del rt–PA y difiere por tres sustituciones en la cadena del aminoácido. Una treonina es reemplazada por aspargina, la cual se agrega a un sitio glucosilado en la posición 103. Una aspargina es sustituida por glutamina modificando un sitio glucosilado en la posición 117 y finalmente se reemplazan cuatro aminoácidos en la proteasa dominante (lisina, histidina, arginina y arginina) por cuatro residuos de alanina. En comparación con alteplasa, estas mutaciones en modelos animales aumentan la vida media, incrementan la especificidad a la fibrina y confiere mayor resistencia a la inhibición inducida por el inhibidor del activador del plasminógeno – 1. En humanos tiene una depuración plasmática más lenta que alteplasa, por lo que su vida media tiene un rango de 11 a 20 minutos en relación con 3 a 5 minutos de alteplasa. Tenecteplasa es más fibrino específico que alteplasa, el cual en este aspecto es mejor que estreptoquinasa o reteplasa. Los niveles del plasminógeno y fibrinógeno sistémico caen del 5 al 15% en las primeras 6 horas después de 30 a 50 mg en relación al 40 ó 50% después de una dosis de alteplasa. El consumo de alfa–2 antiplasmina y del inhibidor de plasmina, así como el incremento del complejo antiplasmina – alfa – 2 plasmina es cuatro o cinco veces mayor con alteplasa que con tenecteplasa. La efectividad de este fibrinolítico de tercera generación en un bolo único de 5 a 10 segundos se explica por mayor fibrino especificidad y porque no induce el fenómeno de "secuestro del plasminógeno".175 El estudio ASSENT–2101 demostró mejor flujo TIMI III con tenecteplasa en comparación con alteplasa y el ASSENT–3 estableció un sinergismo benéfico entre tenecteplasa y enoxaparina, al establecer la mortalidad más baja (5.4%) observada en un estudio de infarto agudo y TF.103 El grupo que recibió heparina no fraccionada tuvo el menor porcentaje de complicaciones hemorrágicas y en todos existió un alto porcentaje (> 30%) de angioplastía o revascularización. El grupo tenecteplasa y heparina no fraccionada tuvo el mayor porcentaje de angioplastía urgente (14.4%, p < 0.0001).135
4. Mecanismos de resistencia y retrombosis
La TF asociada al AAS puede considerarse como el avance más importante en el tratamiento del IMEST. Durante la fase aguda, esta combinación demostró preservar función ventricular y disminuir mortalidad.71 Sin embargo, como cualquier otra forma de tratamiento cardiovascular la TF tiene limitaciones. En la fase aguda se ha observado el fenómeno de resistencia, alto porcentaje de reoclusión (5 a 30%) y baja incidencia de flujo TIMI III (30 a 50%).71Los dos principales mecanismos que pueden limitar la efectividad de la TF son la generación de trombina sistémica (enzima clave de la cascada de la coagulación) y la actividad plaquetaria en el sitio del daño vascular.71 No obstante, otros mecanismos deben ser considerados (Tabla X).71
5. Efectos procoagulantes
La TF no solamente activa el sistema fibrinolítico, también induce un estado de hipercoagulabilidad184 a través de varios mecanismos (Tabla XIII).71 Esto tiene particular importancia en pacientes con infarto en quienes el fenómeno de reoclusión se mantiene como un reto. Marcadores de hipercoagulabilidad incluyen el inhibidor y la concentración de la masa del activador tisular del plasminógeno 1, fibrinógeno, factor XII, complejo trombina – antitrombina III, kalicreína, plasmina y dímero D. Al comparar estreptoquinasa, alteplasa y tratamiento convencional se demostró que el primero ejerce el mayor efecto procoagulante por un incremento relativo en la activación de trombina, (aumento del complejo trombina – antitrombina III) mayor y prolongada actividad de la kalicreína, niveles más altos de dímero D y una mayor reducción en el fibrinógeno con elevación persistente después de 48 horas.184

En la trombosis coronaria aguda se activa la fase de contacto de la coagulación, la vía intrínseca de la coagulación, el sistema fibrinolítico intrínseco y plaquetas. El trombo coronario es rico en plaquetas y después de la TF se activan adhesión, actividad y agregabilidad plaquetaria. En este escenario a través de citometria de flujo se ha demostrado con reteplasa mayor agregación plaquetaria en comparación con alteplasa y mayor incremento de los receptores de expresión plaquetaria y moléculas – 1 de adhesión celular endotelial.184
6. Interacciones farmacológicas
Se han reportado pocas interacciones lo cual puede atribuirse a una vida media relativamente corta y a la falta de desintegración metabólica enzimática. Aunque evidencia reciente sugiere que los nitratos pueden incrementar la depuración de alteplasa, disminuir la probabilidad de reperfusión y aumentar riesgo de reoclusión, esto no ha sido confirmado. El empleo concomitante de medicamentos que modifican la hemostasis como heparina no fraccionada, HBPM, IGPIIb/ Illa o cualquier otro anticoagulante o antiplaquetario, disminuyen la retrombosis pero incrementan exponencialmente la incidencia de complicaciones hemorrágicas, principalmente al combinarlos por el sinergismo inherente.185
7. Contraindicaciones para terapia fibrinolítica
La hemorragia es el evento adverso más importante y frecuente en todos los estudios publicados. La hemorragia intracraneana, la complicación más seria y temida– se observa principalmente en > 75 años con cualquier régimen fibrinolítico en porcentajes que no superan el 1%. La estreptoquinasa, aunque tiene una mayor respuesta antigénica, posee el menor índice de hemorragia intracraneana en comparación con fibrinolíticos fibrino específicos. Considerando que una complicación hemorrágica puede poner en peligro la vida, o inclusive ser mortal, es importante identificar contraindicaciones absolutas y relativas, las cuales aplican para cualquier régimen fibrinolítico (Tabla XII). Deben ser consideradas como contraindicaciones absolutas cirugías vasculares neurológicas, en aorta o médula espinal, por el territorio comprometido y lo complejo del acceso quirúrgico. En otras cirugías mayores se han considerado 10 días como una ventana prudente, sin embargo, siempre debe evaluarse el riesgo beneficio y qué tan accesible es el sitio quirúrgico para el control de la posible hemorragia. Las contraindicaciones relativas, a pesar de ser el resultado innegable de recomendaciones históricas sin ningún apoyo científico, sólo han contribuido en parte a la subutilización de laTF.133,186

Al evaluar el impacto de la TF sobre mortalidad y hemorragia intracraneal en dos grupos en los que se consideró que fue sobre o subutilizada, se observó que la TF se utilizó en el 13% de aquellos que no reunían criterios o que tenían alguna contraindicación (sobreutilización). La reperfusión farmacológica se utilizó en el 14% del grupo sin contraindicaciones (subutilización). En los dos grupos la TF se asoció con menor mortalidad, aun en pacientes con enfermedad vascular cerebral previa. No se observó incremento en el riesgo relativo de hemorragia intracraneal hospitalaria (RR 50.327, 95% IC: 0.031 a 1.810, pNS).187
En la década de los años noventa existe suficiente evidencia que demuestra el beneficio de la TF por lo que sus indicaciones se han ampliado y en los últimos años un número mayor recibe esta estrategia de reperfusión. Sin embargo, todavía se sostiene un número importante de contraindicaciones, (Tabla XIV) considerando la accesibilidad cada vez mayor de ICP en pacientes de alto riesgo para complicaciones hemorrágicas, es poco probable por el riesgo inherente de complicaciones hemorrágicas que en el futuro alguna de estas contraindicaciones desaparezca.
8. Tratamiento de complicaciones hemorrágicas
Se debe neutralizar la plasmina y reponer los sustratos del plasminógeno hemostáticamente activos, como fibrinógeno, factor V, factor VIII y plaquetas. Para neutralizar la plasmina se debe infundir inhibidores naturales como plasma fresco congelado. Al proveer inhibidores de la plasmina y del plasma, se reponen proteínas hemostáticamente activas que son degradadas por la plasmina, como fibrinógeno, factor V y factor VIII. Se recomienda iniciar con 4 unidades de plasma fresco congelado y titular la dosis subsiguiente para mantener niveles de fibrinógeno por lo menos en 100 mg%. Es importante establecer que la TF no es la única responsable de esta complicación y generalmente se requiere un daño reciente en la pared del vaso. Únicamente cuando existe la percepción de que el riesgo de la hemorragia supera al beneficio de la TF se deben minimizar sus efectos.188
G) Tratamiento adjunto
Existe suficiente evidencia obtenida a través de grandes estudios multicéntricos, bien diseñados, aleatorios, con cientos de miles de pacientes, que demuestran que el éxito real de la TF no depende únicamente de lograr reperfusión de la arteria responsable del infarto, sino de una estrategia combinada que permita rescatar el mayor porcentaje de miocardio en riesgo, evitar fenómenos de retrombosis, modular la disfunción endotelial y reducir la disfunción parasimpática y la remodelación del ventrículo izquierdo.59,65,76,80–96,99–105
1. Tiempo como tratamiento adjunto
Nivel de evidencia I C
Cuando la TF se realiza dentro de los primeros 60 a 90 minutos se puede lograr una disminución de la mortalidad hasta de un 50% y por cada hora más temprana que se inicie, es posible disminuir la mortalidad total hasta en un 2%, lo que podría traducir 20 pacientes salvados por cada 1,000 enfermos. Esta evidencia y otras sugieren la necesidad de reconocer el tiempo como tratamiento adjunto e implementar estrategias en los servicios de urgencias para establecer el diagnóstico, estratificar el área de miocardio en riesgo y decidir el empleo de TF en un tiempo menor de 30 minutos después de su ingreso.79,106,133,189
2. Ácido acetilsalicílico
Nivel de evidencia I A
La TF asociada AAS puede considerarse como el avance más importante en el tratamiento del infarto con elevación del ST–T. Durante la fase aguda, esta combinación demostró preservar función ventricular y disminuir mortalidad. Cuando se comparó con placebo, el sinergismo entre AAS y heparina no fraccionada disminuyó la mortalidad en un 23%. Cuando a esta estrategia se agregó estreptoquinasa, la mortalidad se redujo en 42%.59,71 El impacto de la TF que incluye un antiadhesivo plaquetario, antitrombínico indirecto y un fibrinolítico fue similar para infartos anteriores e inferiores.71,79 A partir del estudio ISIS–259 la dosis de carga de 300 mg o 150 mg seguido de 62 a 162 mg cada 24 horas se ha utilizado como tratamiento adjunto en más de 300,000 pacientes llevados a TF.59,65,85–96,98–105 El AAS inhibe indirectamente la activación plaquetaria al inactivar en forma irreversible la enzima ciclooxigenasa y detener producción de tromboxano A2 y agregación plaquetaria. Estudios de fase III demostraron que el AAS sólo o combinado con estreptoquinasa disminuye mortalidad y reinfarto no fatal en 1%, sin incrementar el riesgo de complicaciones hemorrágicas. En pacientes con enfermedad vascular reduce eventos adversos como infarto, accidente cerebral y muerte cardiovascular. Meta–análisis recientes sugieren que independientemente del fibrinolítico utilizado y del éxito o fracaso terapéutico, el AAS disminuyó isquemia recurrente (56%), reoclusión angiografía (39%), reinfarto (25%), accidente vascular cerebral (25%) y muerte cardiovascular (15%). Este antiadhesivo plaquetario por su bajo costo, fácil administración, mínimos efectos secundarios y el beneficio demostrado como prevención secundaria durante la fase aguda y en el seguimiento, puede considerarse como el medicamento más importante y completo en el tratamiento del IMEST. Sin embargo, a pesar de su efectividad como prevención primaria,190 secundaria,191 y en el infarto agudo,59 en un grupo imposible de identificar clínicamente, existe fracaso terapéutico expresado por eventos isquémicos recurrentes. Esto puede atribuirse a los siguientes factores: a) débil inhibición plaquetaria; b) no evita la adhesión plaquetaria inicial en la lesión endotelial, c) no impide que el fibrinógeno se adhiera a su receptor, d) no evita la inhibición de la síntesis de prostaciclina; f) por su baja actividad plaquetaria, las catecolaminas pueden atenuar su efecto; g) no inhibe agregación plaquetaria en áreas de alta fricción y estenosis (lesiones críticas); h) falta de respuesta (recurrencia 30 a 40%) y resistencia (a 7 días, el 10% puede no tener ningún efecto); i) cualquier dosis puede causar gastritis o hemorragia; y j) posible interacción adversa con otros medicamentos, como inhibidores de la enzima convertidora de la angiotensina.71
3. Clopidogrel
Nivel de evidencia IB
Las tienopiridinas son un grupo de antiadhesivos plaquetarios que inhiben la función plaquetaria al interferir con la activación inducida por el difosfato de adenosina.192 La combinación de AAS y ticlopidina ha demostrado disminuir el porcentaje de retrombosis posterior a la colocación de una malla endovascular coronaria. La principal limitación de la ticlopidina bajo estas condiciones, es el tiempo tan prolongado que requiere para alcanzar su máxima actividad (7 días).193 El clopidogrel es una nueva tienopiridina con mejor perfil farmacológico y menos efectos adversos.194,195 Su mecanismo de acción consiste en bloquear la activación plaquetaria a través del difosfato de adenosina, al inhibir en forma selectiva e irreversible la unión de este agonista con su receptor plaquetario, afectando la activación dependiente del difosfato de adenosina al nivel de los IGPIIb/IIIa, principales receptores del fibrinógeno en la superficie plaquetaria. Dos horas después de administrar 75 mg por vía oral, se metaboliza en el hígado dando lugar a una inhibición selectiva de la agregación plaquetaria mediada por el difosfato de adenosina.196,197 Su principal ventaja farmacocinética consiste en alcanzar el 80% de su máxima actividad noventa minutos después de administrar una dosis oral de 300 mg y este efecto es posible extenderlo como una efectiva prevención secundaria.71
La evidencia experimental,198 y clínica,199 sugiere que al combinar la dosis de carga de AAS (325 mg) y clopidogrel el sinergismo mediado por un antagonismo simultáneo sobre el tromboxano A2 y el difosfato de adenosina establece un importante efecto antitrombótico sostenido por importante disminución de la actividad plaquetaria y de la fibrina.71 Esto sugiere que la dosis de carga de estos antiadhesivos plaquetarios, podría atenuar los mecanismos de retrombosis y mejorar la perfusión en pacientes llevados a TF. Como ventaja adicional, esta asociación podría mejorar los resultados de una ICP temprana200 y ofrecer una prevención secundaria más efectiva.192 Los resultados del estudio multicéntrico CLARITY200a sugieren que el empleo de la dosis de carga de 300 mg ofrece una mejor perfusión coronaria en comparación al sólo uso de AAS. Los resultados de este estudio aunque no ofrecen ninguna evidencia de seguridad en > 75 años, raza latina e infusión de alteplasa en 60 minutos, sí demuestran que la incidencia de complicaciones hemorrágicas mayores en la fase aguda y a 30 días fue aceptable. No existe una clara explicación para establecer porqué los enfermos que recibieron estreptoquinasa y heparina no fraccionada tuvieron el mayor efecto benéfico (reducción en % RM 44 y 42 respectivamente) y queda como una interrogante sin contestar si una dosis de carga de clopidogrel mayor podría tener implicaciones favorables o desfavorables en la evolución de estos pacientes. Aunque no fue un estudio de mortalidad, en la fase hospitalaria en ambos grupos se observó una incidencia de mortalidad muy baja (2.6% y 2.2%). A 30 días se observó un mayor beneficio en el grupo que recibió clopidogrel (14.1% vs 11.6%, RM 0.80, IC 95%, 0.65 a 0.97, p = 0.03) en términos de mortalidad. La evidencia de este estudio sugiere que este antiadhesivo plaquetario en IMEST mejora la perfusión epicárdica y reduce la incidencia de isquemia recurrente.
4. Heparina no fraccionada
Hipótesis de la trombina
La fibrinólisis y la trombosis son un proceso simultáneo y dinámico, en donde diferentes factores derivados de la TF pueden amplificar el fenómeno de retrombosis. El trombo mural residual con trombina ligada a la fibrina induce mayor formación de fibrina y es un estímulo potente para la activar la agregación plaquetaria. Hasta el momento, no existe evidencia que demuestre que los antiadhesivos plaquetarios en monoterapia o combinados inhiban este mecanismo. Además, la TF genera plasmina, un procoagulante por activación de los factores V y Va, el cual acelera la formación de trombina a través del complejo protrombinasa. Por otra parte, los dos fibrinolíticos más utilizados (estreptoquinasa y alteplasa) pueden inducir activación plaquetaria y específicamente, la estreptoquinasa genera anticuerpos antiestreptoquinasa que estimulan la agregación plaquetaria. Para que la TF tenga éxito, se requiere que el balance entre los fenómenos dinámicos de lisis y retrombosis se incline a favor de la lisis.71
En el infarto con elevación del ST, la utilidad de la heparina no fraccionada como tratamiento adjunto a la TF para mantener permeabilidad de la arteria es controvertida.201 Evidencia angiográfica (90 minutos) sugiere que la administración de heparina no fraccionada posterior a estreptoquinasa o alteplasa, no ofrece ningún beneficio.201,202 Sin embargo, otros estudios demuestran que mejora el flujo coronario.203 Las limitaciones de la heparina no fraccionada son: a) no actúa sobre la trombina ligada a la fibrina; b) el factor Xa en el complejo protrombinasa se encuentra protegido por el complejo heparina–antitrombina III; c) se neutraliza a través del factor 4 plaquetario; d) el monómero fibrina II inhibe el complejo heparina–antitrombina III; e) fenómeno de reactivación, activado al suspender la infusión y al desaparecer el efecto terapéutico. Clínicamente se expresa por incremento de eventos cardiovasculares adversos (isquemia recurrente, infarto y revascularización urgente; y f) riesgo de complicaciones hemorrágicas y g.) requiere monitorizar el TTPa (Tabla XIV).1 Las ventajas son: a) bajo costo; b) efectivo antídoto; c) al suspender la infusión el efecto terapéutico se limita en poco tiempo. Durante la TF se genera trombina la cual activa plaquetas e induce vasoconstricción coronaria.204 La producción de trombina y la actividad plaquetaria incrementan la formación de protrombina,205,206 lo cual aumenta 300,000 veces la actividad de la trombina. La trombina inducida por la TF, establece un estado altamente protrombótico que condiciona fracaso terapéutico mediado por fenómenos de retrombosis y reoclusión. Hipotéticamente un inhibidor directo o indirecto de trombina podría tener mayor efectividad si se administra antes de laTF.
Heparina no fraccionada y alteplasa
Nivel de evidencia IA
Aunque la heparina no induce una lisis más rápida del trombo, cuando se utiliza con fibrinolíticos fibrino específicos parece existir mejor permeabilidad coronaria.207,208 Con estos fibrinolíticos se puede utilizar la dosis estándar65,91,94,99 o reducida102,103 en forma concomitante y durante las siguientes 24 ó 48 horas manteniendo un TTPa terapéutico, el cual se debe monitorizar cada 3,6, 12 y 24 horas o de acuerdo al TTPa (Tabla XIV). En esta tabla se observan algunas recomendaciones para el manejo de la infusión de heparina cuando se utiliza la dosis ajustada al peso.102 Aunque ningún estudio aleatorizado controlado ha demostrado la superioridad del régimen estándar o reducido en términos de reoclusión o complicaciones hemorrágicas, evidencias recientes sugieren que el monitoreo frecuente del TTPa y dosis ajustada al peso de heparina pueden disminuir el riesgo de complicaciones hemorrágicas fuera del sistema nervioso central.102,209 Además, un TTPa > 70 segundos parece asociarse con mayor mortalidad, recurrencia y complicaciones hemorrágicas.210,211 El único estudio multicéntrico que ha utilizado la dosis ajustada al peso de heparina no fraccionada ha sido el ASSENT–3 observando un menor índice de complicaciones hemorrágicas en relación al grupo con HBPM.103
Heparina no fraccionada y estreptoquinasa
Nivel de evidencia IIa B
Aunque angiográficamente no parece existir mejor perfusión coronaria cuando se asocia heparina no fraccionada a este fibrinolítico, no hay evidencia moderna a favor ni en contra para utilizar heparina no fraccionada con cualquier régimen de estreptoquinasa.71,104,209 Si consideramos la hipótesis de la trombina,104 la actividad plaquetaria en el sitio del daño vascular, así como la actividad del sistema fibrinolítico y el estado protrombótico inherente al fibrinolítico, el empleo de heparina podría justificarse. El estudio HERO 2104 intentó revalidar la hipótesis de la trombina al iniciar con un bolo e infusión de heparina no fraccionada o bivalirudina antes del régimen estándar de estreptoquinasa. El objetivo primario fue mortalidad a 30 días y el secundario incluyó reinfarto y complicaciones hemorrágicas. Las características básales de los dos grupos fueron similares en relación a la localization del infarto, Killip y Kimbal I y II (96% vs 96%) e inicio de los síntomas en las primeras 4 horas (70% en los dos grupos). La mortalidad en ambos no tuvo diferencia estadísticamente significativa, (p = 0.85) pero en el grupo bivalirudina existió reducción de eventos adversos (p = 0.001). Este beneficio se obtuvo a expensas de un incremento de hemorragias graves, (no intracraneal) (1% vs 0.5%, p = 0.07) moderadas, (1.4% vs 1.1%, (p = 0.05) y menores (p < 0.0001). Sin embargo, no hubo diferencia en relación con el número de transfusiones (1% vs 1%). El bajo índice de hemorragia intracraneal (0.4% vs 0.6%) podría estar en relación con el empleo de estreptoquinasa y la inclusión de grupos de bajo riesgo. Aunque este estudio probó que el uso de un inhibidor directo de trombina disminuye eventos cardiovasculares en infarto agudo con elevación del ST de bajo riesgo, falló en disminuir mortalidad. La falta de un grupo control con y sin heparina no fraccionada, impidió revalidar la hipótesis de la trombina. La interrogante relacionada con la utilidad de la heparina no fraccionada asociada a estreptoquinasa continúa.71
Heparina no fraccionada y tenecteplasa
Nivel de evidencia IA
En los estudios ASSENT–232 y ASSENT–3, se demostró en términos de seguridad que el empleo de una dosis completa de tenecteplasa asociada a la dosis ajustada al peso de heparina no fraccionada tuvo menor índice de complicaciones hemorrágicas (2.2% vs 4.7%) y transfusiones (2.3% vs 4.7%).35 Estos resultados apoyaron indirectamente el uso de este régimen con monitoreo temprano del TTPa. Aunque entre enoxaparina y la dosis reducida no existió diferencia en el porcentaje de hemorragia intracraneal, sí se observó menor incidencia de complicaciones hemorrágicas mayores y menores para la heparina no fraccionada. A pesar de que en el grupo con enoxaparina se observó la menor incidencia de isquemia recurrente y del fácil empleo de la HBPM, aún debe revalidarse si la enoxaparina debe reemplazar a la dosis ajustada de heparina no fraccionada.103
5. Heparina de bajo peso molecular
Como profilaxis en trombosis venosa profunda, la HBPM es una eficaz alternativa a la heparina no fraccionada y en IMEST ha disminuido el porcentaje de trombosis en el ventrículo izquierdo. En el contexto de una enfermedad coronaria inestable, dalteparina cada 12 horas con AAS, disminuyó más del 50% el riesgo de muerte o infarto cuando se comparó con AAS. En pacientes con enfermedad coronaria aguda inestable, la HBPM ha demostrado por los menos tener la misma efectividad que la heparina no fraccionada.212 Comparada con heparina no fraccionada, la de bajo peso molecular tiene las siguientes ventajas: a) vida media más prolongada; b) mayor y más predecible biodisponibilidad; c) no requiere laboratorio para monitorizar efectividad, ni bomba de infusión continua.71 Las potenciales desventajas son: a) en presencia de disfunción ventricular grave y bajo gasto renal la vida media se alarga; b) antídoto parcial, el sulfato de protamina sólo inactiva el 60% de los anti Xa; c) mayor incidencia de complicaciones hemorrágicas; d) se desconoce el nivel óptimo de anticoagulación en > 75 años, con insuficiencia renal, obesidad co–mórbida y durante ICP.213
Heparina de bajo peso molecular y tenecteplasa
Nivel de evidencia IA
El empleo de enoxaparina como tratamiento adjunto con este fibrinolítico de tercera generación deriva de los resultados del estudio ASSENT–3. El empleo de un bolo de 30 mg seguido inmediatamente por la primera dosis subcutánea de 1 mg por kilogramo de peso cada 12 horas hasta el alta hospitalaria o al 7° día sin pasar de 100 mg demostró un efecto benéfico en términos de seguridad y menores eventos adversos cardiovasculares103 (Tabla XIII). Aunque el porcentaje de revascularización temprana fue alto, la combinación de tenecteplasa con enoxaparina disminuyó la frecuencia de isquemia recurrente. Esto podría atribuirse a una reperfusión más fina a través de las características farmacológicas de esta HBPM y a que la terapéutica antitrombínica prolongada (7 días) es mejor que una corta, (24 a 48 horas)213 a expensas de un incremento en la tendencia hemorrágica. Por su fácil administración ambos medicamentos emergen como una atractiva alternativa de reperfusión farmacológica.103
Heparina de bajo peso molecular y estreptoquinasa
Nivel de evidencia IA
Al asociar HBPM como tratamiento adjunto a estreptoquinasa, se ha observado disminución de reinfarto y angina y rápida elevación y actividad del antifactor Xa.71,214,215 Al utilizar dalteparina se obtiene un mejor flujo angiográfico, sin embargo, 24 a 72 horas posteriores a la suspensión, existe evidencia que sugiere reactivación de la trombosis, isquemia recurrente y reinfarto. No existió diferencia en ambos grupos en relación a revascularización o muerte. La HBPM fue bien tolerada y el evento adverso más frecuente fue equimosis en los sitios de punción.216 El AMI–SK105 estudio de fase II evaluó la combinación del régimen estándar de estreptoquinasa más enoxaparina (bolo de 30 mg y 1 mg/kg/d/3 a 8 días vs o placebo) a través del flujo TIMI 3 al 8avo día, (rango 5 a 10 días) la resolución del ST y eventos adversos, (isquemia recurrente, reinfarto y fallecimiento). La media de duración del tratamiento fue de 5 días. La resolución del segmento ST a 90 (p = 0.01) y 180 minutos (p = 0.004) fue favorable para enoxaparina. En este grupo se obtuvo un mejor flujo TIMI 3 (70%) en comparación a placebo (58%, p = 0.004). Al analizar la combinación de TIMI 2 y 3 el resultado fue similar (88% vs 72%, p = 0.001). Enoxaparina también disminuyó a 30 días eventos cardiovasculares adversos, (13% vs 21%, p = 0.03). Aunque hubo mayor tendencia para complicaciones hemorrágicas en el grupo enoxaparina, (4.8% vs 2.5%, p 0.02) no hubo diferencia estadísticamente significativa. La estreptoquinasa pudo influir en el mínimo porcentaje de hemorragia intracraneana observado (0% vs 1.3%, p NS). Aunque el estudio tiene limitaciones como el tiempo tan prolongado para realizar la angiografía coronaria, esta estrategia podría ser una alternativa. Es necesario esperar estudios de fase III con una mayor muestra para establecer conclusiones finales.71
Heparina de bajo peso molecular y alteplasa
Nivel de evidencia I C
Este fibrinolítico ha demostrado históricamente con diferentes regímenes, ventanas terapéuticas y dosis de heparina ser una alternativa terapéutica efectiva en el tratamiento del IMEST65,85,88,89,91,92–94,96,98–102 y en la era moderna ha sido el régimen de referencia para comparar los fibrinolíticos de tercera generación.100,102 Estas nuevas alternativas excluyeron a este fibrinolítico del escenario clínico que permitiera establecer la seguridad y efectividad de alteplasa asociada a HBPM. Aunque no existe evidencia a favor, tampoco hay fundamentos para no utilizar HBPM con este fibrinolítico. El estudio TIMI 28 trata de identificar la seguridad y efectividad de enoxaparina con cualquier régimen fibrinolítico, por lo que los resultados ofrecerán evidencia que permita establecer el papel de enoxaparina con alteplasa.
6. Nitratos
Reducen la demanda de oxígeno y la tensión de la pared al disminuir la precarga y postcarga del ventrículo izquierdo. En forma indirecta mejoran la perfusión del área de miocardio en riesgo, al inducir la producción de óxido nítrico, mejoran la disfunción endotelial (vasoespasmo), dilatan la circulación colateral (si existe) y disminuyen la presión diastólica final del ventrículo izquierdo.132 Pueden tener serios efectos colaterales como taquicardia y estados hiperdinámicos reflejos, que en forma secundaria disminuyen la perfusión diastólica. En presencia de una obstrucción coronaria crítica un estado de hipotensión secundario puede disminuir la presión de perfusión miocárdica.132 En pacientes con IMEST considerados para estreptoquinasa deben evitarse antes de iniciar el fibrinolítico ya que el efecto sinérgico puede expresarse por un estado de hipotensión grave.169
En la Tabla XI se observan los niveles de evidencia en diferentes escenarios clínicos de un IMEST. Si no existe ninguna contraindicación como hipotensión, choque o extensión al ventrículo derecho en donde el riesgo supere al beneficio, estos medicamentos han demostrado en meta–análisis reducir la mortalidad.54 Sin embargo, en el estudio GISSI–356 no se observó ningún beneficio en mortalidad con el uso rutinario por vía endovenosa. Cuando se utilizó un mononitrato por vía oral o molsidomina, un nuevo donador del óxido nitro, tampoco existió ningún beneficio.55,217 Por lo tanto, el uso rutinario en IMEST de bajo riesgo podría no ser recomendado. Sin embargo considerando que en la fase aguda de un SCA existe la posibilidad de una ruptura de placa múltiple en el sistema coronario (30 a 40%) deben utilizarse en esta fase por el beneficio que podrían ofrecer al estimular la producción de óxido nítrico, atenuar la disfunción endotelial y reducir eventos adversos por vasoconstricción.
7. Bloqueadores beta
Su principal efecto consiste en modular la hiperactividad simpática inducida por la disfunción parasimpática para retomar la variabilidad de la frecuencia cardíaca, que en el momento actual debe considerarse como el principal mecanismo que atenúa la génesis de arritmias ventriculares graves.221 Por su efecto sobre el nodo AV disminuyen el consumo de oxígeno lo que permite limitar la extensión y disminuir isquemia recurrente y mortalidad.24,222,223 Aunque su utilidad por vía endovenosa ha sido claramente demostrada, en nuestro medio sólo contamos con preparados por vía oral los cuales podrían ser suficientes. Deben utilizarse en la fase aguda cuando no existan contraindicaciones como bradicardia, bloqueo AV, hipotensión, edema pulmonar (por disfunción sistólica), e historia de broncoespasmo61–132 (Tabla XV).
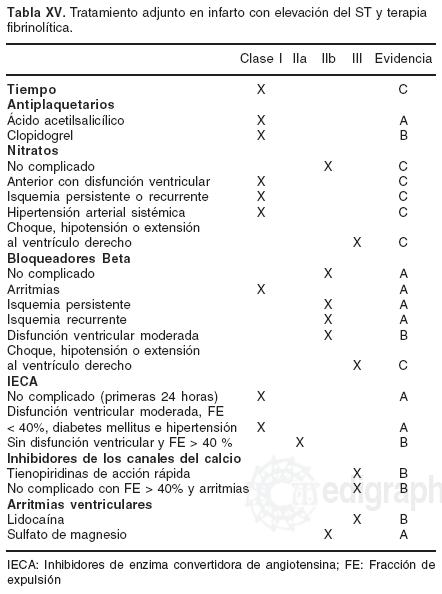
Antes de la TF todos los estudios realizados con bloqueadores beta por vía endovenosa en IMEST, demostraron a 7 días reducción absoluta de la mortalidad (4.3% a 3.7%) o seis vidas salvadas por 1,000 pacientes tratados.225 En la era de la TF aunque dos estudios aleatorizados identificaron un menor número de eventos no fue posible establecer una conclusión final.226,227 Un subestudio del GUSTO–I que evaluó el uso de atenolol y una revisión sistematizada, no apoyaron el uso rutinario de los bloqueadores beta por vía endovenosa.228,229En la práctica el paciente ideal para bloqueadores beta es < 60 años, con manifestaciones de hiperactividad simpática como taquicardia y cifras de TA en límites superiores o hipertensión leve, sin patología crónica preexistente, adecuada superficie corporal y FE lo más cercano posible a lo normal. Es importante enfatizar que en todo paciente con taquicardia antes de iniciar este tratamiento se debe descartar hipovolemia o disfunción ventricular sistólica. Pueden utilizarse en cualquier forma de disfunción diastólica. Desafortunadamente este grupo de pacientes no es frecuente y la gran mayoría tienen dentro de su sustrato clínico una o más contraindicaciones para su empleo.
8. Inhibidores de la enzima convertidora de angiotensina
Deben utilizarse en la fase temprana de un IMEST cuando exista disfunción ventricular o se demuestre una fracción de expulsión anormal. Tres importantes estudios multicéntricos demostraron que los inhibidores de la enzima convertidora de angiotensina (IECA) disminuyen la mortalidad55,217,230 El estudio CONSENSUS II231 no pudo reproducir estos resultados al utilizar la vía endovenosa, sin embargo, una revisión sistematizada estableció que los IECA son seguros y bien tolerados. A 30 días logran disminuir (pequeña pero significativa) la mortalidad, obteniendo el mayor beneficio en la primera semana. Actualmente hay suficiente evidencia para iniciar un IECA en las primeras 24 horas si no hay contraindicaciones.232 Sin embargo, su utilidad en grupos de bajo riesgo e infarto inferior no es clara.
9. Inhibidores de los canales lentos del calcio
Teóricamente ofrecen beneficios al disminuir la demanda de oxígeno, inducir vasodilatación y proteger miocardio en riesgo al evitar el ingreso excesivo del calcio al interior de la célula isquémica. Estos resultados teóricos promisorios experimentales no se han podido reproducir en estudios clínicos.233 Un meta–análisis falló en demostrar que estos inhibidores mejoran la mortalidad y sugiere que las dihidropiridinas de acción rápida tuvieron estrecha relación con taquicardia, riesgo de muerte y reinfarto.234 Con los inhibidores que actúan sobre el nodo AV se observó menor riesgo de infarto (20%), pero no mejoraron la mortalidad y cuando existió mala fracción de expulsión el riesgo de insuficiencia cardíaca fue mayor.235 Los eventos adversos se observan con mayor frecuencia con dihidropiridinas de acción rápida por hiperreactividad simpática secundaria, directamente responsable del efecto proisquémico, inotrópico negativo y arritmogénico. También deben considerarse otros efectos como vasodilatación y el efecto prohemorrágico.235 Por lo anterior, en el momento actual no existe ninguna evidencia que apoye el empleo de los antagonistas del calcio en la fase aguda de un IMEST. Sin embargo en casos en donde existe una clara contraindicación para el empleo de bloqueadores beta, los inhibidores de los canales del calcio con acción sobre el nodo AV (verapamilo o diltiazem) podrían ser considerados.132
10. Lidocaína
En el substrato de un IMEST la génesis de cualquier arritmia ventricular o supraventricular dependerá principalmente del fenómeno isquémico. Para atenuar la incidencia de arritmias en la fase aguda se requiere de una rápida estrategia combinada de reperfusión, antitrombótica y antiisquemia, para que a través de diferentes mecanismos se intente proteger miocardio en riesgo atenuando la isquemia o limitando el frente de necrosis subendocárdico, que en la fase aguda son determinantes en la génesis de arritmias mortales.132 En IMEST durante los primeros minutos por extrasístoles ventriculares frecuentes con o sin fenómeno de R/T y el riesgo de fibrilación ventricular es frecuente el empleo de lidocaína profiláctica. Sin embargo, debe tenerse precaución con este antiarrítmico, ya que una evidencia sistematizada sugiere incremento en la mortalidad.236 Por lo tanto, para evitar una arritmia ventricular se requiere de una reperfusión rápida temprana y sostenida de la arteria relacionada con miocardio en riesgo, reservando el empleo de infusiones de lidocaína para un selecto grupo de alto riesgo con taquicardia o fibrilación ventricular recidivante y sin evidencia de isquemia recurrente o extensión del infarto.132
11. Sulfato de magnesio
Estudios de meta–análisis sugirieron un efecto benéfico en la fase aguda de un IMEST,237,238sin embargo, el ISIS–455no apoyó estos resultados, lo que se ha atribuido a una dosis subóptima. El estudio MAGIC tampoco confirmó la utilidad de este medicamento.239
H) Recomendaciones prácticas
Aunque la selección del fibrinolítico tiene una importancia marginal en relación con la necesidad de iniciar la reperfusión farmacológica tan rápido como sea posible, deben considerarse algunos principios.
• Se recomienda alteplasa o tenecteplasa en pacientes previamente tratados con estreptoquinasa, ya que aunque pueden recibir con seguridad una nueva infusión durante los primeros 10 días, la presencia de anticuerpos puede neutralizar su efecto fibrinolítico.
• El régimen estándar de estreptoquinasa podría ser el de elección en grupos de riesgo alto para hemorragia intracraneal.
• Es preferible utilizar alteplasa o tenecteplasa en < 60 años dentro de las primeras dos horas del inicio de los síntomas, en Killip y Kimball 1 ó 2, con área extensa de miocardio en riesgo y sin accesibilidad a ICP.
• La ICP es la estrategia de reperfusión en presencia de grave disfunción ventricular, sin embargo, si no existe esta posibilidad y aunque la evidencia es limitada, el régimen estándar de estreptoquinasa podría ofrecer algún beneficio.
• En pacientes con cirugía de derivación aortocoronaria previa e IMEST, el mayor beneficio pudiera obtenerse con un fibrino específico más potente como alteplasa.
• En presencia de cifras de TA en límites inferiores por condiciones clínicas (Bezold–Jarisch o hipovolemia) o uso excesivo de analgésicos, vasodilatadores o diuréticos es preferible utilizar alteplasa o tenecteplasa.
• La asociación de una carga de clopidogrel (300 mg) y AAS (150 mg a 350 mg) podría lograr una mejor perfusión epicárdica, sin embargo, se requiere mayor evidencia en pacientes latinoamericanos.
VI. Estrategias de reperfusión mecánica
A) Introducción
La reperfusión temprana durante el IMEST ha demostrado reducir la mortalidad y preservar la función ventricular cuando se lleva a cabo en las primeras horas de la evolución del mismo. Sin embargo, un número importante de pacientes no logran ser reperfundidos, o no son elegibles para tratamientos fibrinolíticos, o bien, sufren reoclusión de la arteria responsable del infarto. Sin embargo, las estrategias de reperfusión farmacológica no logran esta meta en una proporción importante de pacientes240 y muchos de ellos se presentan con más de 12 horas de evolución de los síntomas241 y por ello no alcanzan los criterios para ser incluidos en protocolos fibrinolíticos. Además, alrededor del 10% de los pacientes, sufren una reoclusión temprana de la arteria que ya se había reperfundido240 y otros tantos no pueden ser sometidos a intervención coronaria percutánea primaria debido a la falta de recursos tecnológicos que prevalece aún en las sociedades más industrializadas. De tal manera que un número importante de pacientes quedan con la arteria responsable del infarto ocluida.
Nomenclatura de las variedades de angioplastía en infarto agudo del miocardio:
La variedad en la nomenclatura que se maneja en la angioplastía coronaria para el infarto agudo del miocardio ha generado confusión y dificultad para extrapolar los datos provenientes de los estudios clínicos.242,243 Es imperativo para el intervencionista familiarizarse con esta terminología.
1. Angioplastía primaria o directa: es aquella que se lleva a cabo en el paciente que no ha recibido fibrinolíticos intravenosos para el manejo de su infarto agudo.
2. Angioplastía facilitada: es aquella que va precedida de la administración de: a) Inhibidores de glicoproteína IIb/III, b) Dosis reducidas al 50% de fibrinolíticos, c) la combinación de ambos o d) dosis totales de fibrinólisis, la cual es realizada en las primeras 12 hs de evolución del IMEST.
3. Angioplastía inmediata postrombólisis: es la que se lleva a cabo en las primeras horas después de haber recibido tratamiento trombolítico.
4. Angioplastía de rescate: es cuando el paciente es llevado a angioplastía porque no hay evidencia de reperfusión con el trombolítico intravenosos y existen datos de inestabilidad hemodinámica.
5. Angioplastía diferida postrombólisis: es la que se realiza después de 24 a 36 horas posteriores a la administración del trombolítico, exista o no evidencia de isquemia residual.
6. Angioplastía electiva "guiada por isquemia: se lleva a cabo antes del alta hospitalaria, solamente cuando el paciente tiene evidencia objetiva de isquemia residual, espontánea o inducida.
7. Angioplastía tardía: se lleva a cabo más de una semana y menos de un mes después del evento agudo, en pacientes que no tienen isquemia residual. Existe mucha información en la literatura acerca de cada una de estas variedades y debe de tomarse en cuenta esta clasificación cuando se quieran extrapolar los resultados ya que, indudablemente, éstos son diferentes entre sí.
B) Angioplastía primaria
Es definida como la angioplastía (ACTP) realizada dentro de las primeras 12 horas de evolución del IMEST y que no va precedida de la administración de fibrinólisis o de algún inhibidor de glicoproteína IIb/IIIa. Es considerada como la estrategia "ideal" de repercusión, siempre y cuando pueda ser llevada a cabo en los siguientes 90 minutos del primer contacto médico con el paciente. Es de suma importancia recalcar que se requiere de un equipo de cardiólogos intervencionistas experimentados y de todo un sistema logístico entre los servicios de urgencias, unidad coronaria y el laboratorio de hemodinamia perfectamente coordinados para reducir al máximo los tiempos totales de reperfusión. Lo anterior significa que sólo hospitales que cumplan con dichos requisitos podrán implementar un programa de angioplastía primaria, el cual deberá estar disponible las 24 hs del día, durante todo el año y de tal forma podrán obtenerse los resultados deseados. Las bajas tasas de mortalidad entre los pacientes que ingresan a angioplastía primaria se han observado principalmente en centros con alto volumen de procedimientos por año.244 La primera ACTP primaria fue reportada en 1979,245 sólo dos años después de la introducción de la ACTP coronaria electiva. Desde entonces muchos estudios aleatorizados han mostrado la superioridad de la ACTP primaria sobre la terapia fibrinolítica como modalidad de tratamiento de reperfusión en el infarto con elevación del segmento IMEST, lo anterior se ha visto reflejado en diversos subgrupos de pacientes, como mujeres246 y ancianos247 quienes se han visto en particular mayormente beneficiados. Un meta–análisis de 23 estudios aleatorizados,248 con un total de 7,339 pacientes distribuidos a terapia fibrinolítica o ACTP primaria dentro de las primeras 12 hs de evolución del infarto agudo del miocardio, reveló los siguientes hallazgos: la ACTP primaria fue mejor que la fibrinólisis en reducir a corto plazo muerte (9.3% vs 7.0%, p = 0.0002), re–infarto no fatal (6.8% vs 2.5%, p < 0.0001), EVC (2.0% vs 1.0%, p < 0.0004) y la combinación de todos los anteriores puntos primarios (14.5% vs 8.2%, p < 0.0001); durante el seguimiento a largo plazo (6–18 meses) los beneficios se mantuvieron, observándose una tasa de muerte de 12.8% vs 9.6%, re–infarto no fatal 10.0 vs 4.8% y la combinación de muerte, reinfarto y EVC fue de 19% vs 12%, todos los anteriores datos con significancia estadística a favor de la ACTP primaria.248–251 La mayor diferencia a favor de la ACTP primaria ha sido la reducción de isquemia recurrente (6% vs 21% de la fibrinólisis p < 0.0001) a corto plazo y de 22% vs 39% (p < 0.0001) a largo plazo. La ACTP primaria ha mostrado eficacia y seguridad en mantener la permeabilidad de la arteria "relacionada" al infarto sin conllevar los riesgos de sangrado de la terapia fibrinolítica. El implante "rutinario" de stent durante la ACTP primaria disminuye la necesidad de reintervenciones futuras en los vasos tratados con una significativa reducción en las tasas de muerte, reinfarto e isquemia recurrente252,253 cuando se compara a la ACTP con balón. Pacientes con contraindicaciones para terapia fibrinolítica, quienes muestran mayor morbi–mortalidad que los pacientes elegibles a fibrinólisis, representan una población en quienes la ACTP primaria resulta ser mandataria.254 La ACTP primaria puede ser llevada a cabo de manera exitosa en la gran mayoría de los pacientes255 y sin duda alguna representa el tratamiento de elección en los pacientes con choque cardiogénico. En la Tabla XVI se resumen las diferentes indicaciones y sus niveles de evidencia de la ACTP primaria.

C) Angioplastía "facilitada"
La ACTP "facilitada" es un concepto que nace con la intención de conjuntar las estrategias de reperfusión farmacológicas con las mecánicas, con el objetivo de obtener una temprana recanalización coronaria, mediante la utilización de inhibidores de glicoproteínas, dosis medias de fibrinolíticos o ambos, mientras el paciente arriba al laboratorio de hemodinamia y con ello limitar la necrosis miocárdica.
1. ACTP "Facilitada " por fibrinólisis
Sin duda alguna los agentes fibrinolíticos (a dosis media o total) representan una alternativa interesante, sin embargo existe la preocupación por el potencial incremento en el riesgo de sangrado. Estudios angiográficos piloto256,257han mostrado una mayor permeabilidad de la arteria relacionada al infarto, en pacientes quienes fueron pre–tratados con dosis reducidas de agentes fibrinolíticos (r–tPA, r–PA, TNK) e inhibidores de glicoproteína IIb/ IIIa (abciximab, eptiñbatide, tirofibán) antes de su arribo al laboratorio de hemodinamia, sin embargo dicho beneficio angiográfico no se ha visto acompañado de un impacto benéfico desde el punto de vista clínico. Aunque la mortalidad no ha sido reducida en comparación a la monoterapia con terapia lítica257,258estudios a gran escala están aún por definir el papel de la ACTP "facilitada". A la fecha han sido ya reportados resultados de algunos estudios como SASTRE, BRAVO, ADVANCE–MI259–261 y los resultados han sido un tanto contradictorios; mientras en el primero se obtuvieron los mejores resultados con la combinación de 50 mg de r–tPA+tirofibán, en el segundo, abciximab solo tuvo mejores resultados sólo que combinado con media dosis de r–tPA. Recientemente el estudio ASSENT–4 fue detenido antes de su finalización, debido a que los resultados parciales ofrecían una superioridad de la ACTP directa, sobre los grupos que fueron facilitados previamente con dosis completa de TNK. Sólo esperamos los resultados del estudio FINESSE262 para aclarar el verdadero lugar que tendrá la ACTP "facilitada" como estrategia de tratamiento en el paciente con infarto y elevación del IMEST.
2. ACTP "Facilitada" por inhibidores de glicoproteína IIb/IIIa
En el estudio ADMIRAL,263 todos los pacientes que recibieron abciximab desde la ambulancia o en la sala de urgencias, mostraron mejores resultados que aquellos que recibieron la droga en sala, sugiriendo un efecto benéfico "facilitador". En el estudio ON–TIME264 los pacientes fueron aleatorizados a recibir tirofibán en sala de urgencias o en el laboratorio de hemodinamia; el flujo TIMI III inicial estuvo presente en el 19% de los pretratados en sala de urgencias vs 15% de los tratados en sala de hemodinamia, sin embargo no se tradujo en beneficio clínico alguno. Los estudios TIGER–PA265 y el BRIDGING266 sugieren que la administración temprana de tirofibán o abciximab mejora los resultados angiográñcos en pacientes sometidos a ACTP primaria y un meta–análisis de 6 estudios aleatorizados267 refiere un beneficio angiográfico en permeabilidad con una tendencia favorable en eventos clínicos, con la administración de inhibidores IIb/IIIa.
En conclusión, respecto a la ACTP "facilitada" no existe la suficiente evidencia para sugerirla como modalidad de tratamiento superior a la ACTP primaria o directa (Tabla XVIII).

D) Transferencia a centros de intervención coronaria
No existe duda de que pacientes que se presentan dentro de las primeras 12 horas de iniciados los síntomas de un infarto con elevación del IMEST, pero que tienen contraindicaciones para recibir fibrinólisis, deben ser enviados inmediatamente al hospital más cercano que tenga programa de ACTP primaria.
Se ha observado que los pacientes no elegibles para fibrinólisis, tienen una mayor morbi–mortalidad que aquellos que son elegibles268 es por ello , que la ACTP primaria representa la única oportunidad para dichos pacientes de lograr alguna estrategia de reperfusión. Aun que existen diversos ensayos aleatorizados que muestran superioridad de la estrategia de transferir al paciente a centros de ACTP primaria, sobre la fibrinólisis in–situ en el hospital de primer contacto, (LIMI,269PRAGUE–1,270 PRAGUE–2,271 AIR–PAMI,272y DANAMI–2273 la decisión de llevar a cabo dicha transferencia del paciente es tomada en base a la estratificación de riesgo del paciente, así mismo de la logística adecuada para dicho traslado y los tiempos de retardo que ello conlleva.274 El estudio DANAMI–2273 fue el primero en mostrar una reducción significativa de los puntos primarios de muerte, reinfarto y EVC después de 30 días en pacientes transferidos a ACTP primaria, comparados vs fibrinólisis, a pesar de un retraso en el traslado de los pacientes. El PRAGUE–2271 fue prematuramente detenido, debido a que existió un aumento de 2.5 veces en mortalidad en los pacientes que recibieron fibrinólisis con > 3 hs de iniciados los síntomas (15.3% vs 6% p < 0.02)); los pacientes que fueron trombolizados con < 3 hs de iniciados los síntomas, la mortalidad fue similar a la observada en pacientes transferidos para ACTP primaria (7.4% vs 7.3%). Dentro de las primeras 3 hs de iniciados los síntomas, la fibrinólisis representa una estrategia viable de tratamiento como se observó en PRAGUE–2,271 STOPAMI1 y 2,275 MITRA y MIR276 además del CAPTIM277 con fibrinólisis extrahospitalaria. De tal forma, dentro de las primeras 3 hs de iniciados los síntomas, ambas estrategias de reperfusión son igualmente efectivas en reducir el tamaño del infarto y mortalidad.
La mayor razón por la cual se puede preferir la ACTP primaria sobre la fibrinólisis, aún dentro de las primeras 3 hs de iniciados los síntomas, es la disminución del EVC. Como ya fue comentado previamente, en un meta–análisis de 23 estudios aleatorizados, se redujo la posibilidad de EVC a 1% en los pacientes con ACTP primaria vs 2% de los pacientes con fibrinólisis. Resultados similares en la reducción de EVC fueron observados en el meta–análisis PCAT278 y CAPTDVI.277 El meta–análisis enfocado sólo sobre los estudios de transferencia a centros de ACTP vs fibrinólisis in situ, mostró una incidencia de EVC de 0.64% para la ACTP y de 1.88% para la fibrinólisis.
E) ACTP de rescate
Uno de los procesos más extensamente estudiados en la cardiología moderna, es la trombólisis. El valor terapéutico de la fibrinólisis para mejorar la función ventricular y la sobrevida de los pacientes con infarto de miocardio ha sido plenamente demostrado. Aún así con los esquemas trombolíticos convencionales, históricamente ha sido conocido que en aproximadamente 25% de los pacientes no es posible restaurar la permeabilidad del vaso relacionado al infarto y solamente entre el 50 y 60% de los pacientes alcanzaban flujo TIMI 3.279–283 También es bien conocido que los pacientes con reperfusión temprana subóptima (TIMI < 3) tienen significativamente peor pronóstico que los pacientes con reperfusión completa, como es posible apreciar en la Tabla siguiente que sumariza algunas de las observaciones de diferentes autores284 que han analizado la relación entre la mortalidad y el flujo TIMI. A pesar de que en estudios más recientes285 en los cuales se utilizaron regímenes más modernos de asociaciones farmacológicas (Tecneteplase más enoxaparina o abciximab) han reportado porcentajes más bajos de muerte, re–infarto intrahospitalario o de isquemia refractaria intrahospitalaria (5.4%, 2.7% respectivamente para el tecneteplase + enoxaparina y 6.6%, 2.2% para tecneteplase + abciximab), sabemos que hasta la fecha se considera que existe un grupo de pacientes en quienes la trombólisis no es suficiente para re–permeabilizar adecuadamente el vaso culpable y es en esta situación donde la intervención coronaria percutánea de rescate (ICPR) puede ofrecer al enfermo mejorar las posibilidades de rescatar miocardio en riesgo y de esta manera mejorar la función ventricular y en consecuencia las posibilidades de sobrevida. Se ha llamado intervención coronaria percutánea de rescate (ICPR) a aquella que se realiza en los pacientes que aun habiendo sido sometidos a terapia fibrinolítica no han alcanzado criterios de reperfusión exitosa (síntomas persistentes, angina post–infarto, falla cardíaca, choque, ST sin resolución o resolución incompleta, demostración angiográfica de flujo TIMI < 3).
Históricamente debemos recordar que múltiples estudios observacionales del principio de la década de los 90 demostraron que la ACTP de rescate era efectiva en restituir el flujo de la arteria relacionada al infarto en una elevada proporción de los casos de enfermos con arterias ocluidas después de la trombólisis pero asociada a una tasa de reoculsión elevada (18%), en ese entonces se consideraba que pocas veces había mejoría significante de la función ventricular.286,287 Aunque los pacientes con ACTP de rescate exitosa parecían obtener beneficio clínico, la incidencia de mortalidad era mayor que en pacientes solamente con trombólisis exitosa y en los pacientes con ACTP de rescate no exitosa tenía pobre pronóstico.287,288 Estos datos condujeron a algunos investigadores a sugerir que la ACTP de rescate podría por sí misma ser dañina, tal vez por la posibilidad de disección hemorrágica más extensa en la pared del vaso después del trauma vascular producido por el balón en la pared del vaso y los efectos inducidos por la trombólisis en la activación plaquetaria.289,290 Sin embargo uno debe ser cuidadoso en la interpretación de los datos derivados de estos estudios ya que existe claramente un sesgo en la selección de estos pacientes, ya que los pacientes que eran sometidos a ACTP de rescate en estos estudios, tenían desde luego, mayores tiempos a reperfusión que los pacientes con trombólisis exitosa y de entrada, por definición, los pacientes con trombólisis fallida representaban un grupo de mayor riesgo. En el momento actual, estos estudios tienen valor histórico, ya que fueron realizados en una época en la que los regímenes de anticoagulación eran conducidos sin control del tiempo de coagulación activado (ACT), desde luego, los inhibidores de las glicoproteínas IIb–IIIa no estaban clínicamente disponibles y el uso de las prótesis endovasculares no era rutinario, los dispositivos de trombectomía mecánica no fueron utilizados y desde luego no existían prótesis liberadoras de fármacos. No obstante, la información derivada de estos estudios sentó las bases de la ICPR contemporánea y es conveniente conocer las observaciones de los diferentes grupos de trabajo que han sido pioneros en este campo para poder normar nuestro criterio. Dos estudios aleatorizados a este respecto fueron publicados la década previa (Belenkie y RESCUE) y uno más en este año de 2003 (MERLÍN), además de varios estudios observacionales con números pequeños de pacientes que serán brevemente revisados a continuación.
Cuando uno analiza los estudios aleatorizados en este tema es conveniente recordar las observaciones de Belenkie y colaboradores291 quienes estudiaron 28 pacientes con arterias relacionadas al IMEST infarto persistentemente ocluidas después de tratamiento trombolítico a más de 3 horas del inicio del IMEST; los pacientes fueron aleatoriamente asignados a ACTP de rescate (n = 16) o tratamiento conservador (n = 12). Hubo tendencia a una menor mortalidad intrahospitalaria en el grupo de ACTP de rescate (6.3% vs 33.3%; p = 0.13). La conclusión de estos investigadores fue que, aunque el número de pacientes aleatorizados fue pequeño, la tendencia a disminuir la mortalidad daba soporte a la hipótesis de que la ACTP de rescate pudiera ser benéfica.
En el estudio RESCUE290 (Randomized Evaluation of Salvage Angioplasty with Combined Utilization of End points) se analizaron 151 pacientes con infartos de cara anterior con elevación del segmento ST (primer infarto) a quienes se les demostró angiográficamente que después de haber sido sometidos a trombólisis, tenían ocluido el vaso relacionado al infarto y que se encontraban aún dentro de las primeras 8 horas del inicio de los síntomas, estos enfermos fueron aleatoriamente asignados a dos grupos terapéuticos: Tratamiento médico vs ACTP (con Balón) de rescate. El éxito primario de la ACTP fue de 92.3%. No hubo diferencias entre los dos grupos en la FEVI en reposo, aunque la FEVI de ejercicio fue discretamente más alta en el grupo de ACTP de rescate (43% vs 38%; p = 0.04). Hubo una tendencia a menor mortalidad a 30 días y (5.1% vs 9.6%; p = 0.18) y hubo menos insuficiencia cardíaca congestiva (NYHA III o IV) (1.3% vs 7.0%; P = 0.11) en el grupo de ACTP de rescate. Un beneficio estadísticamente significativo fue reportado para el grupo de ACTP de rescate en los puntos finales combinados de muerte o insuficiencia cardíaca congestiva severa a 30 días (6.4% vs 16.6%; p = 0.05). La fracción de eyección fue similar en los dos grupos (40% vs 39%).
Aunque la aleatorización en los estudios de Belenkie y Ellis confiere a estos estudios mayor peso, es importante revisar también un grupo de estudios que si bien no son aleatorizados han contribuido al conocimiento de la utilidad de la ACTP e intervención coronaria percutánea de rescate y a continuación se resumen algunos de ellos en la Tabla XIX.284
En el estudio TIMI–4 se evaluó el papel de la ICPR en una serie de 402 pacientes tratados con fibrinólisis (estudio observational).295 De 58 pacientes a quienes se intentó el rescate, 52 tuvieron éxito primario en la intervención pero su mortalidad fue de 10% (más del triple que la de los pacientes con trombólisis exitosa que fue de 3%; p < .01). Evaluada globalmente, la incidencia de efectos adversos fue igual para los pacientes sometidos a ICPR que para aquellos que no habiendo respondido a la fibrinólisis, no fueron sometidos a intervención (35% en cada caso).
En el subestudio angiográfico derivado del GUSTO–1, estudio también observacional, se compararon los resultados de 198 pacientes a quienes se les intentó ACTP de rescate con los resultados de 266 pacientes en quienes también hubo falla de la trombólisis pero que fueron tratados conservadoramente.296 Tanto la función ventricular izquierda como la mortalidad a 30 días fueron similares en los dos grupos y menos favorables que la de aquellos pacientes en quienes la trombólisis fue inicialmente exitosa. La mortalidad después de ACTP de rescate fallida fue de 30.4%. Debe enfatizarse que éste no fue un estudio randomizado y que puede haber desviaciones no deseadas resultado de evaluar la ACTP en grupos no adecuadamente comparables, probablemente con diferencias básales en el riesgo de la población sometida a ACTP y el riesgo basal de los sometidos a tratamiento conservador. En el estudio CORAMI294 se evaluaron 299 pacientes trombolizados en los que se consideró que hubo 87 pacientes con criterios de trombólisis fallida, 15 de los cuales no fueron considerados candidatos a ACTP y 72 fueron sometidos a ACTPR. El punto final primario clínico fue mortalidad intrahospitalaria y el punto final angiográfico fue flujo TIMI 3 antes del alta. La ACTPR fue exitosa en 65/72 pacientes (90%), sobrevivieron 69/72 pacientes (96%), sólo 5/72 tuvieron reoclusión angiográfica (7%); se alcanzó flujo TIMI 3 en 93% de los pacientes y no hubo re–infartos ni cirugías de revascularización de emergencia.
Es muy importante hacer mención de las observaciones del meta–análisis de S. Ellis y colaboradores, quienes después de revisar 9 estudios randomizados de ICPR299 concluyeron que, la ICPR después de trombólisis fallida (flujo TIMI–0 a 1) redujo la insuficiencia cardíaca severa temprana (3.8% ví 11.7%; p = .04). Mejoró la sobrevida durante un año en pacientes con infartos de tamaño moderado a grande (92% vs 87%; p = .001) y posiblemente redujo la incidencia de reinfarto temprano (4.3% vs 11.3%; p = .08). Los pacientes en quienes falla la ICPR tuvieron mortalidad alta.
La reducción de la incidencia del re–infarto temprano, cobra mayor interés si se tienen en mente las observaciones hechas por Gibson y cols,300 del grupo de trabajo TIMI en el que siguiendo la hipótesis específica de que el reinfarto temprano se asocia a mayor mortalidad, después de analizar los datos de mortalidad de 20,101 pacientes en los estudios TIMI 4,9,10b y en el estudio InTIME–II, les parece claro que la recurrencia temprana del infarto (4.2% de incidencia) se asocia a incremento de la mortalidad temprana a 30 días (16.4% vs 6.2%) y hasta los dos años (divergencia temprana a 30 días, el incremento de la mortalidad a 2 años no se debió a un incremento significante de la mortalidad tardía) y que la utilización de ICP durante la hospitalización inicial se asoció a menor riesgo de re–infarto (1.6% vs 4.5%) y a menor riesgo de mortalidad a dos años (5.6% ví 11.6%).
Aunque el fundamento bibliográfico del beneficio del uso de prótesis endovasculares (stents) en la ACTP primaria lo han hecho prácticamente de uso rutinario, en el campo de la ICPR hay realmente pocos reportes bibliográficos en los que la ACTP sea asistida por el uso de stents. Rodríguez y cols301 reportaron los resultados de 30 pacientes con infarto del miocardio, incluyendo 13 enfermos que fueron sometidos a ICPR con uso de stents. La entrega del stent fue exitosa en los 13 enfermos y la única muerte intrahospitalaria que ocurrió fue en el grupo de los pacientes que fueron sometidos a ICPR y dicho paciente se encontraba en choque cardiogénico. Otro estudio de un grupo Español de Intervencionistas302 buscó evaluar la factibilidad y la seguridad del uso de prótesis endovasculares (stents) durante ICPR en el infarto de miocardio después de trombólisis fallida. En el estudio analizaron 20 pacientes con infarto de miocardio, referidos para ICPR después de trombólisis fallida (75% tPA n = 15; APSAC en 5% n = 1; STK 5% N = 1. Se incluyeron 3 pacientes en el estudio INTIME II) que fueron tratados con stents y posteriormente a la prótesis endovascular el manejo farmacológico fue con aspirina 200 mg/día y ticlopidina 250 mg 2v/día. En este grupo de pacientes se colocaron 30 stents (1.5 ±1.0 por paciente). El éxito angiográfico fue obtenido en 19 pacientes (95%), 2 pacientes (10%) murieron, ambos por complicaciones de sangrados severos. Un paciente (5%) sufrió reinfarto. Pero no hubo pacientes que tuvieran angina post–infarto o que necesitaran una nueva revascularización del vaso blanco. Dieciocho pacientes (90%) fueron dados de alta vivos y libres de eventos. A los seis meses de seguimiento todos estos pacientes permanecieron asintomáticos y sin necesidad de revascularización del vaso blanco. Los autores concluyeron que la colocación de stents durante ICPR es factible y segura y se asocia a buenos resultados clínicos y angiográficos. En su serie las complicaciones por sangrado pareció ser la principal limitación de esta estrategia de reperfusión. El uso de los inhibidores de las glicoproteínas lib Illa también ha sido explorado tratando de mejorar los resultados de los pacientes sometidos a ICPR. En el estudio EPIC (Evaluation of c7E3 (abciximab) to Prevent Ischemic Complications) Lefkovits y cols303 reportaron los resultados de 66 pacientes sometidos a ACTP primaria (n = 44) o a ICPR (n = 22). Los resultados no fueron analizados separadamente porque ambos grupos tuvieron resultados similares, sin embargo, este grupo de investigadores reportaron una reducción significativa en los puntos primarios compuestos (Muerte, re–infarto, cirugía de revascularización de emergencia, o repetición de angiografía de emergencia) entre los pacientes tratados con abciximab, en bolo o en infusión cuando los resultados son comparados con los del grupo placebo tanto a 30 días (4.5% vs 26.1%, p = 0.06) como a seis meses (4.5% vs 47.8%; p = 0.002). Éstos fueron de los estudios pioneros que han provisto la evidencia inicial de la utilidad del uso de los inhibidores de las glicoproteínas IIb IIIa durante ACTP primaria y durante ICPR.
En 2001, Upendra Kaul y cols304 publicaron un estudio observacional también con un número reducido de pacientes, en el que sugieren que, en la ACTP de rescate, la utilización de stents y el uso de los inhibidores de las glicoproteínas IIb IIIa podrían mejorar los resultados clínicos y angiográficos, sin incremento significante del riesgo de sangrado y con disminución del riesgo hospitalario. Será muy importante esperar por estudios semejantes pero con mayor número de pacientes y mayor peso estadístico para validar con mayor contundencia estas observaciones. Sin embargo, el número limitado de estudios que integren las modalidades terapéuticas contemporáneas en el subgrupo de pacientes con ICPR hacen que estos estudios, aunque pequeños y observacionales tengan valor y posiblemente cimentarán las bases de la evidencia de lo que en el momento actual pudiese ser considerado como la tendencia moderna en el tratamiento endovascular de los pacientes con trombólisis fallida. Cuando se hace referencia a pacientes sometidos a ICPR con cierta frecuencia y en forma implícita se considera que se trata de un grupo de individuos cuyas características generales, por definición, los hacen ser de alto riesgo. Con frecuencia en los diferentes ensayos, los grupos de estudio tienen que incluir pacientes en estado de choque que por sí mismos forman un capítulo diferente por lo que hay una tendencia a analizarlos separadamente de las intervenciones en este subgrupo de enfermos. Sin embargo, con frecuencia se encuentran inmersos en los diferentes grupos de pacientes que se someten a ICPR, y esto ha creado una situación en la que se ha dado pie a la necesidad de analizar alternativas de apoyo mecánico a la ICPR, específicamente debemos referirnos al uso del balón intraórtico de contrapulsación (BIAC), cuya utilización también ha sido explorada en el intento de mejorar los resultados de pacientes con estado de choque y en las ICPR complejas o de alto riesgo. Algunos estudios no randomizados305,306 han sugerido que el uso del BIAC puede ser de utilidad para disminuir la re–oclusión y mejorar la función ventricular izquierda306 después de reperfusión en el IMEST. Sin embargo, los resultados de los estudios aleatorizados han sido controversiales. En los Estados Unidos, el grupo de estudio del BIAC (IABP Study Group) aleatoriamente asignó 182 pacientes enviados para cateterismo de emergencia en las primeras 24 hrs de un IMEST, incluyendo 51 pacientes que tuvieron que ser sometidos a ICPR, al uso del BIAC o a cuidado estándar (Sin BIAC).307 Los autores reportaron una incidencia significativamente menor de puntos finales compuestos (muerte, ACV, re–infarto, ACTP de emergencia o cirugía de revascularización con puentes, o isquemia recurrente) en el grupo tratado con BIAC (13% comparado con 24%; p = 0.04). En contraste, los investigadores del PAMI–II, en 437 pacientes de alto riesgo sometidos a ACTP primaria, asignaron sus pacientes aleatoriamente a BIAC vs manejo médico (no BIAC) y sugirieron que no había beneficio en los resultados clínicos.308 La estrategia donde se incluyó el uso del BIAC, comparada con el grupo en el que no se usó, no redujo la incidencia de re–oclusión de la arteria relacionada al infarto (6.7% vs 5.5%, p > 0.2), ni el re–infarto (6.2% vs 5.5%; p > 0.2) y tampoco la muerte intrahospitalaria (4.3% vs 3.2%; p > 0.02); en cambio, fue asociada a una mayor incidencia de accidente cerebrovascular (2.4% vs 0%; p = 0.03). Además, el BIAC no mejoró la recuperación miocárdica, la FEVI medida en reposo y ejercicio seis semanas después del alta. En otro estudio, Ishihara y sus colegas309 en forma no aleatoria asignó los primeros 20 pacientes consecutivos con infarto anterior que fueron sometidos a ICPR a manejo sin BIAC y los siguientes 40 enfermos de características similares a manejo que incluyó BIAC. Los pacientes tratados con BIAC tuvieron una disminución significativa en la tasa de re–oclusión (2.5% vs 25%; p < 0.05), la media de la FEVI pre–alta fue mejor (incremento de 6.8 puntos porcentuales comparado con disminución de 2.0 puntos porcentuales; p < 0.05) y una tendencia estadísticamente no significante a disminuir la mortalidad. Estos estudios pudieran sugerir que el uso del BIAC puede ser de ayuda en la ICPR, sin embargo, los resultados negativos del PAMI II obligan a ser cautelosos en el juicio y a esperar estudios subsecuentes dirigidos a evaluar los resultados del BIAC en la ICPR. Estudios más recientes han tratado de establecer los beneficios a corto plazo y los resultados a largo plazo de la ICPR. En este contexto las observaciones del grupo Koreano del Dr. YJ Hong310 adquieren relevancia. Los autores comparan los resultados de 31 pacientes sometidos a ICPR (grupo I; 59.7 ±11.4 años, 80.6% varones) con los resultados de 177 pacientes tratados con ICP primaria (Grupo II, 59.7 ± 9.7 años, 79.7% varones), tratados entre enero de 1997 y diciembre de 1999, con el objeto de evaluar los resultados clínicos y angiográficos de la ICPR, la incidencia de éxito del procedimiento y la sobrevida a largo plazo de la ICPR. La mayor relevancia de este estudio es destacar la similitud de resultados entre la ICPR y la ACTP primaria en el sentido que, el éxito primario y la sobrevida a 1 mes fueron semejantes para ambos procedimientos (93.6% y 93% para ICPR vs 94.9 y 94% para ACTP primaria). Sus conclusiones finales fueron que: a) la ICPR se asociaba más a historia de tabaquismo, b) La indicación de ICPR fue más común en pacientes con choque cardiogénico. c) La incidencia de éxito primario de la ICPR fue muy comparable a la de ACTP primaria, d) En el seguimiento a largo plazo de la función ventricular ésta muestra mejoría después de la ICPR. e) La ICPR tiene una sobrevida a largo plazo relativamente alta. Una vez más, cabe destacar que la muestra de pacientes con ICPR es relativamente pequeña, sin embargo, sus resultados, a diferencia de los resultados de los estudios de principios de la década de los 90's, pudieran sugerir que con las técnicas de ICPR utilizadas entre 1997 y 1999, se obtuvieron mejores resultados en la función ventricular que los obtenidos a inicio de la década pasada, y, definitivamente el éxito primario y la sobrevivencia a 1, 6 y 12 meses que se obtuvo en los casos de ICPR, en esa época, fueron comparables entre la ICPR (31 pacientes) y la ACTP directa (177 pacientes).
En 2003 (TCT Scientific Session) Andrew Sutton, del Hospital Universitario James Cook, Middlesbrough, Reino Unido, presenta un estudio aleatorizado (MERLÍN) cuyo objetivo fue comparar la ICPR con tratamiento conservador (fibrinólisis) en pacientes con infarto con elevación de ST y reperfusión fallida. Choque cardiogénico fue criterio de exclusión de este estudio. El punto final primario fue mortalidad a 30 días y secundario fue punto final compuesto de muerte, re–infarto, revascularización no planeada, accidente cerebrovascular e insuficiencia cardíaca. En este estudio fueron incluidos 307 pacientes y fueron asignados aleatoriamente a tratamiento conservador (n = 154) o ICPR (n = 153). La conclusión de este estudio fue que la ACTP de rescate tuvo mortalidad a 30 días similar a la del tratamiento conservador (ICPR 9.8% vs Tx cons. 11.0%; p = 0.7); sin embargo los pacientes tratados conservadoramente (sin ICPR) tuvieron una incidencia más alta de punto secundario compuesto (ICPR 37.3% vs Tx Cons 50.0%; p = 0.02) debido al incremento en el requerimiento de intervención urgente (revascularización no planeada, ICPR 6.5% vs Tx cons 20.1%; p < 0.01).
Recientemente en AHA 2004 (New Orleans) Gershlick presentó los resultados del estudio aleatorizado REACT, en donde fueron incluidos 427 pacientes con trombólisis fallida, definida como la no reducción del 50% de elevación del segmento ST. Los pacientes fueron distribuidos en 3 grupos: ACTP de rescate, manejo conservador y re–trombólisis. La incidencia de puntos finales primarios (muerte, reinfarto, EVC y datos de insuficiencia cardíaca) fueron significativamente menores en el grupo de ACTP de rescate, comparados con los grupos de manejo conservador y retrombólisis (15.3% vs 29.8 y 31%) respectivamente con OR 0.47 (0.28–0.79), IC 95% con p < 0.004. La tasa de sobrevida a 6 meses fue 84.6% para ACTP de rescate vs 70 y 68% para los grupos de manejo conservador y re–trombólisis respectivamente (p < 0.004). Aunque en el proceso de definir el éxito de un procedimiento de trombólisis los parámetros clínicos, electrocardiográficos y enzimáticos proveen de una buena guía para tratar de establecer el diagnóstico de reperfusión, identificar la permeabilidad del vaso relacionado al infarto después de trombólisis en algunas situaciones, continúa siendo un reto. Es posible que técnicas más actuales de imagen no invasiva, como la tomografía coronaria (TAC helicoidal de 16 detectores) y la resonancia magnética nuclear, puedan brindar información que permita identificar con mayor certeza la persistencia de la oclusión del vaso culpable después de la trombólisis y si esto puede ser diagnosticado con mayor celeridad y certeza, tal vez en el futuro veamos un uso más frecuente de la ICPR. No obstante, por el momento, debe considerarse que los pacientes que tienen dolor de pecho persistente y persistencia de la elevación del segmento ST después de la trombólisis, deben ser sometidos a angiografía coronaria para determinar la permeabilidad del vaso culpable, con el objeto de poder establecer con claridad la necesidad de ser sometido a ICPR si el vaso permanece ocluido.
En base de los estudios observacionales de la década anterior, los estudios aleatorizados y los más recientes que incluyeron el uso de las técnicas contemporáneas de la cardiología intervencionista, parece haber evidencia suficiente para considerar que la intervención coronaria percutánea de rescate ofrece una alternativa razonable para los enfermos con trombólisis fallida (Tabla XVIII).
F) ACTP durante la convalecencia de un IMEST
En este apartado trataremos las variedades de ACTP inmediata, diferida y electiva y más adelante la ACTP tardía. Al entender que la arteria responsable del infarto quedaba con obstrucciones residuales importantes después de la trombólisis en un número significativo de pacientes, se intentó abordar éstas mediante ACTP durante las primeras horas de la trombólisis exitosa. A esto se le llamó ACTP inmediata. El estudio TAMI311 aleatorizó 197 pacientes después de una trombólisis exitosa, si la arteria responsable del infarto había quedado con una lesión residual de más de 70% a un brazo en el que se realizaba ACTP con balón inmediata, durante la angiografía "índice" o a un segundo brazo al cual se le realizó una ACTP diferida, 7 días después. No hubo diferencia significativa en la mortalidad (inmediata 3.3%, diferida 1.4%), en la fracción de expulsión del ventrículo izquierdo (inmediata 59%, diferida 57%), ni en la tasa de reoclusión (11.9 vs 10.5%), sin embargo, la ACTP inmediata se asoció a una mayor incidencia de cirugía de revascularización miocárdica de emergencia (6.5 vs 1.4%), lo cual puede resultar catastrófico después de haber administrado fibrinolíticos. El siguiente estudio que abordó este problema fue el ECSG,312 que aleatorizó de acuerdo a internación de tratamiento, antes de la angiografía 367 pacientes a angiografía inmediata y revascularización mediante ACTP con balón o a angiografía y re vascularización diferidas 10 a 20 días después de la administración de 100 mg de tPA. En este estudio hubo una diferencia significativa en la mortalidad (ATCP inmediata 6.2% vs ATCP diferida 2.5%, p < 0.05), aunque no hubo diferencia en la fracción de expulsión (inmediata 57%, diferida 54%) ni en la tasa de reoclusión coronaria (inmediata 10.2%, diferida 11.8%). El último estudio que abordó este tema fue el TIMI 2a313 en donde se aleatorizaron 389 pacientes a angiografía y ACTP con balón inmediatas o diferidas 18 a 48 horas después de la administración de 100 a 150 mg de tPA intravenosos. Hubo una tendencia a mayor mortalidad en el grupo tratado en forma inmediata (6.7 vs 4.1%), aunque no alcanzó significancia estadística. No hubo diferencia en la fracción de expulsión (inmediata 54%, diferida 52%). Hubo también una tendencia a una mayor incidencia de cirugía de emergencia y de transfusiones en el grupo enviado a intervención coronaria inmediata (5.7 vs 1.8% y 18 vs 5.8%, respectivamente). Con estos tres estudios, se dio por asentado que la ACTP inmediata, después de una trombólisis clínicamente exitosa aumentan el riesgo del procedimiento y por lo tanto la estrategia fue abandonada.
Mas recientemente, los autores del estudio SIAM III cuestionaron este concepto, argumentando que los pobres resultados de los estudios previos eran debido a que los resultados de la ACTP con balón son consistentemente inferiores a los de la agioplastía asistida con prótesis endovasculares.314 En un pequeño estudio multicéntrico, aleatorizado, prospectivo y controlado, 82 pacientes recibieron un stent a la arteria responsable del infarto dentro de las primeras 6 horas de la trombólisis y los compararon con 81 pacientes a los que se les colocaron las prótesis 2 semanas después del evento índice. La colocación inmediata de stents se asoció a una reducción significativa de la tasa de eventos combinados a los 6 meses (muerte, reinfarto y revascularización del vaso culpable 25.6 vs 50.6%, p = 0.001), llevándolos a la conclusión de que la colocación de prótesis endovasculares inmediatamente después de una trombólisis exitosa presenta una menor tasa de eventos cardíacos importantes cuando se compara con el tratamiento más conservador consistente en diferir la colocación de las prótesis dos semanas.
Dos estudios importantes han comparado la estrategia de realizar una ACTP diferida después de la trombólisis contra la estrategia de realizar una ACTP electiva, es decir, sólo para los pacientes que quedan con isquemia residual después de la trombólisis. El primero es el estudio TIMI II315,316 que aleatorizó 3,339 pacientes a una estrategia de ACTP con balón diferida, sin evidencia de isquemia residual o a una estrategia de ACTP con balón electiva, sólo si mostraban isquemia residual. No hubo diferencia en la tasa de muerte o reinfarto a las 6 semanas (10.9 vs 9.7%) ni al año (14.7 vs 15.2%). El segundo estudio fue el SWIFT317 en donde se aleatorizaron 400 pacientes a ACTP con balón diferida y 400 pacientes a ACTP con balón electiva, sólo si había isquemia residual después de una trombólisis para infarto del miocardio. La mortalidad a un año fue de 5% para la estrategia diferida y de 5.8% para la electiva y la tasa de infarto a un año fue de 15.1% para la estrategia diferida y de 12.9% para la electiva. Una vez que se comprobó que la estrategia de revascularizar a los pacientes después de la trombólisis solamente si tenían isquemia residual y no en forma indiscriminada, sin tener en cuenta de si los pacientes tenían isquemia o no, quedaba por contestar la pregunta de si valía la pena revascularizarlos o podrían seguir solamente con tratamiento médico. El estudio DINAMI, un ensayo clínico, multicéntrico, controlado y aleatorizado318 evaluó 503 pacientes sometidos a una estrategia invasiva 2 a 10 semanas después de trombólisis y los compararon con 505 pacientes que manejaron conservadoramente con tratamiento médico óptimo. El seguimiento fue de 1 a 4.5 años y los puntos finales del estudio fueron mortalidad, reinfarto y admisión hospitalaria por angina inestable. No hubo diferencia significativa en la mortalidad (estrategia invasiva 3.6%, estrategia conservadora 4.4%). El tratamiento invasivo se asoció a una menor tasa de infarto al miocardio (5.6 vs 10.5%, p = 0.0038) y menos admisiones por angina inestable (17.9 vs 29.5%, p < 0.00001). El punto final primario del estudio se alcanzó en 15.4 vs 29.5% a un año, 23.5 vs 36.6% a 2 años y 31.7 vs 44% a 4 años (p < 0.00001) en el tratamiento invasivo y conservador, respectivamente. Los autores concluyeron que los pacientes con isquemia inducible después de haber recibido tratamiento trombolítico para un primer infarto agudo del miocardio, deben ser referidos a angiografía y revascularización miocárdica (Tabla XVIII).
1. Hipótesis de la arteria abierta tardía
Varios estudios observacionales han demostrado que la permeabilidad tardía de la arteria responsable del infarto se asocia a un mejor pronóstico, lo cual parece ser independiente de la fracción de expulsión del ventrículo izquierdo y de la anatomía coronaria y es particularmente evidente en los subgrupos de alto riesgo.319 Además, cuando la arteria responsable del infarto permanece cerrada, la apoptosis de las células miocárdicas continúa, hecho inexistente cuando la arteria responsable del infarto queda abierta.320 Existe evidencia que sostiene que la reperfusión de la arteria responsable del infarto mediante trombolíticos, más allá de las primeras 12 y posiblemente 24 horas después del infarto puede ser benéfica.321 Este beneficio potencial, independiente del tiempo, que confiere la reperfusión tardía, nos ha llevado a la modificación del paradigma de la reperfusión temprana introduciendo "la hipótesis de la arteria abierta tardía".322,324 Existe evidencia experimental y clínica que sugiere que la repercusión tardía tiene efectos benéficos sobre la remodelación ventricular izquierda, la estabilidad eléctrica del miocardio y el flujo de las colaterales coronarias.325,327
2. ACTP tardía sin isquemia residual
Estudios de cohortes del tipo de los casos y controles han sugerido que permeabilizar la arteria responsable del infarto tiene consecuencias benéficas en el pronóstico a largo plazo del infarto agudo del miocardio. En el subestudio angiográfico del SAVE328 se evaluaron 288 pacientes de 21 a 80 años, con FEVI < 40% y sin isquemia residual, mediante angiografía coronaria "clínicamente dirigida" y fueron revascularizados de acuerdo al criterio del médico tratante. La arteria fue "reabierta" en 130 pacientes y se dejó ocluida en 158. La mortalidad a un año fue de 11% en aquellos sujetos a los que se les permeabilizó la arteria responsable del infarto y de 24% en los que se les dejó ocluida (p = 0.004). La mortalidad por causas cardiovasculares fue de 9 y 23%, respectivamente (p = 0.001) así como la tasa de eventos combinados, la cual también favoreció al grupo en los que se volvió a permeabilizar la arteria responsable del infarto (32 vs 51%, p = 0.002).
Dentro de los primeros estudios aleatorizados que se realizaron para responder esta pregunta está el TOPS, ensayo clínico, multicéntrico, comparando ACTP con balón contra manejo conservador en pacientes que habían sido tratados con trombolíticos intravenosos durante las primeras 6 horas de evolución de un IMEST, que quedaron sin evidencia de isquemia residual clínica o por prueba de esfuerzo y con estenosis de más del 50% de la arteria responsable del infarto antes del alta hospitalaria.329 Incluyeron 42 pacientes en el grupo de angioplastía y 45 pacientes en el grupo para tratamiento conservador, los cuales fueron aleatorizados después de una angiografía que se realizó 4 a 14 días después del infarto. Ambos grupos estaban bien balanceados. La edad promedio era de 57 años y el 85% de los pacientes eran del sexo masculino. El 10% tenía ocluida la arteria responsable del infarto. El éxito angiográfico en el grupo asignado a ACTP fue de 88%, con una estenosis residual de la arteria responsable del infarto de 35% y tuvieron complicaciones relacionadas a la ACTP el 9.5% de los pacientes. A las 6 semanas, no hubo diferencia en la fracción de expulsión del ventrículo izquierdo. La sobrevida sin infarto fue de 88.7% en el grupo de ACTP y de 100% en el de tratamiento conservador (p = 0.07), aunque la sobrevida sin eventos fue similar en ambos grupos. Cabe mencionar que la diferencia fue fundamentalmente en la incidencia y gravedad de la angina de pecho, la cual fue significativamente más importante en el grupo manejado en forma conservadora (clase funcional CCS 0.2 + 0.4 vs 0.5 + 0.7, p = 0.04).
El estudio TOAT es un ensayo clínico aleatorizado que comparó pacientes con DVIEST con ondas Q en la pared anterior, que fueron trombolizados y tenían oclusión persistente de la arteria descendente anterior izquierda 26+18 días después del evento.330 El grupo de pacientes asignados a la intervención percutánea recibieron tratamiento médico óptimo a base de aspirina, clopidogrel, betabloqueadores e inhibidores de la ECA, además de la colocación de un stent en el sitio de la oclusión. El grupo asignado a tratamiento médico, solamente recibió los medicamentos en forma óptima. El tamaño de la muestra fue calculada estimando un 30% de reducción en el volumen telesistólico, inducido por la intervención percutánea, para lo cual requerían 58 pacientes. Ambos grupos estaban bien balanceados, la edad promedio era de 58 años y 80% eran del sexo masculino. El 97% había sido trombolizado. Los volúmenes ventriculares y flujo TDVII eran similares. Al año, los pacientes fueron recateterizados. El grupo de pacientes asignados a la intervención, es decir, el grupo de la arteria abierta, había empeorado al compararlo con el grupo de la arteria cerrada. Sus volúmenes telesistólicos y telediastólicos eran mayores (106.6 + 37.5 mL vs 79.7 + 34.4 mL, p < 0.01 y 162.0 + 51.4 mL vs 130.1 + 46.1 mL, p < 0.01, respectivamente). Hubo un 11% de reoclusión en el grupo tratado mediante intervención percutánea y un 19% de recanalización espontánea en el grupo tratado conservadoramente. La duración del ejercicio y la carga de trabajo en la prueba de esfuerzo mejoraron en ambos grupos, aunque fue más pronunciada para el grupo de la arteria abierta. En resumen, este estudio sugiere que abrir una arteria ocluida, cerca de un mes después del infarto, puede tener consecuencias deletéreas sobre la función ventricular. Posibles explicaciones para este fenómeno incluyen la posibilidad de embolismos distales a las colaterales, reinfartos durante la intervención, interacciones medicamentosas y preservación de isletas de células viables, posiblemente arritmogénicas. Recientemente fue publicado el ALKK, estudio aleatorizado, abierto, comparando ACTP transluminal coronaria percutánea contra tratamiento médico en sobrevivientes de infarto del miocardio estables, con enfermedad de un vaso.331
Los investigadores evaluaron pacientes que habían padecido un DVIEST, 8 a 42 días antes y que hubiesen sido llevados a estudio angiográfico en donde se identificara claramente la arteria responsable, la cual debería estar ocluida o tener una lesión hemodinámicamente significativa. Excluyeron aquellos que tenían angina clase III–IV CCS y a los que tenían lesiones en otros territorios vasculares diferentes a los del infarto. El punto final primario del estudio fue la sobrevida libre de reinfarto, revascularización miocárdica por isquemia clínicamente significativa y rehospitalización por angina, a un año. Estimaron una reducción de un 40% en la tasa de eventos, del 85 al 75%, para lo cual necesitarían un total de 800 pacientes. El estudio fue suspendido porque hubo una disminución en la tasa de reclutamiento, cuando sólo llevaban un tercio de la muestra. El grupo tratado con ACTP reclutó 149 pacientes y 151 el de tratamiento médico. Ambos estaban bien balanceados, con edad promedio de 58 años, 68% de pacientes del sexo masculino, 15% de diabéticos, 60% habían sido sometidos a trombólisis, 98% tenían angina en clase funcional I CCS y sólo 15% prueba de esfuerzo positiva. Encontraron oclusión total de la arteria responsable del infarto en 28% de los casos. La coronaria derecha fue la responsable en la mitad de los casos y la descendente anterior en una tercera parte. No hubo diferencia a un año en la tasa de muerte (0.7 vs 3.3%), reinfarto no fatal (2.0 vs 4.6%) o cirugía de revascularización miocárdica (0.7 vs 2.7%) entre el grupo tratado mediante ACTP y el tratado en forma conservadora, respectivamente. Los tratados con ACTP, sin embargo, tuvieron una menor incidencia de otra ACTP (5.4 vs 13.2%, p = 0.03) y menor incidencia de nuevas hospitalizaciones por angina de pecho grave (4.0 vs 14.6%, p = 0.007). Al final del año, la sobrevida libre de eventos fue de 90% en el grupo de ACTP y de 82% en el grupo tratado médicamente (p = 0.066). Durante el seguimiento promedio a 52 meses, la mortalidad fue significativamente menor en el grupo de ACTP que en el tratado médicamente (4 vs 11.2%, p = 0.02) así como la sobrevivencia libre de reinfarto o revascularización (80 vs 66%, p = 0.05). Quedan pendientes por terminar dos estudios importantes debido a que el tamaño de su muestra, muy posiblemente contestará las interrogantes que aún tenemos. El primero es el O AT (Open Artery Trial) y el segundo es el estudio italiano ACTOR (Aggresive versus Conservative Treatment of the infarct Related artery after acute MI).
G) Conclusiones
ACTP Primaria
La ACTP primaria se considera el tratamiento de elección para pacientes que se presentan con IMEST, en un hospital con facilidades para llevar a cabo dicho tratamiento y que cuentan con un equipo de cardiólogos intervencionistas experimentados (Tabla XVI). Los pacientes con alguna contraindicación para fibrinólisis deben ser inmediatamente referidos a algún centro hospitalario que cuente con programa de ACTP primaria. Los pacientes con choque cardiogénico hay indicación absoluta de una ACTP primaria emergente, así mismo una revascularización lo más completa posible, lo cual podrá reducir la mortalidad a menos del 50%. Existen algunos estudios aleatorizados que sugieren un mayor beneficio en transferir al paciente con IMEST a algún centro con programa de ACTP primaria, en lugar de trombolizarlo en el hospital de primer contacto, a pesar del retardo que conlleva el transporte a dichos centros; los estudios han sido reportados principalmente en Europa. Consideramos que en nuestro país y en particular en las grandes urbes, dicha conducta de transferir al paciente, no resulta viable. La superioridad de la ACTP primaria sobre la fibrinólisis parece ser especialmente relevante entre las 3 y 12 h de iniciados los síntomas, logrando preservar mayor masa miocárdica y con ello reduciendo la tasa de eventos clínicos como muerte, reinfarto no fatal y EVC. Sin embargo, dentro de las primeras 3 horas de iniciados los síntomas, ambas estrategias (fibrinólisis y ACTP primaria) parecen ser igualmente benéficas, en particular en la primera hora de iniciados los síntomas, la terapia fibrinolítica ofrece resultados similares a la ACTP primaria, reduciendo de manera significativa el tamaño del infarto y la mortalidad. Así, la terapia fibrinolítica, es una alternativa viable a la ACTP primaria y debe ser recomendada en aquellos pacientes que se presentan en las primeras 3 h de iniciados los síntomas.
ACTP facilitada
Los resultados de los pequeños estudios en cuanto a la ACTP "facilitada" han sido un tanto contradictorios, si bien la mayoría de ellos ha reportado una mejoría en la calidad del flujo TIMI antes de la ACTP, dicho efecto no se ha visto traducido en beneficio clínico. Ante el fracaso de la ACTP facilitada observado en el estudio ASSENT–4, el cual tuvo que ser suspendido prematuramente, sólo queda esperar los resultados del estudio FINESSE que se encuentra en proceso.
ACTP rescate
El concepto de trombólisis fallida deberá aplicarse tempranamente, esto es de 45–60 minutos después de iniciada la fibrinólisis. Los pacientes que son intervenidos tempranamente, son quienes muestran los mayores beneficios. Las tasas de éxito del procedimiento, resultado de las mejoras tecnológicas de los dispositivos, stents y drogas antitrombóticas, se ha incrementado de manera significativa, acercándose a las obtenidas en la ACTP primaria. Con los recientes resultados presentados del estudio REACT, parece quedar claro el efecto benéfico de la ACTP de rescate; el reto será identificar tempranamente a aquellos pacientes en quienes la fibrinólisis ha sido fallida.
ACTP inmediata
Debe evitarse la realización de ACTP inmediata, es decir aquella que se lleva a cabo dentro de las primeras horas después de una trombólisis exitosa, ya que incrementa los riesgos de muerte, cirugía de revascularización de emergencia y sangrados clínicamente significativos. Si por algún motivo es necesario realizar una ACTP en las primeras horas después de una trombólisis es aconsejable implantar una prótesis endovascular coronaria, ya que esto parece que mejora el pronóstico a mediano plazo.
ACTP "Rutinaria"post–trombólisis La ACTP diferida, es decir, aquella que se realiza después de la trombólisis en pacientes estables, sin haber investigado la presencia de isquemia residual, debe también de evitarse, ya que no ha demostrado ser superior a la estrategia electiva, es decir, aquella que se lleva a cabo sólo cuando existe isquemia residual, espontánea o inducida.
ACTP "guiada" por isquemia Cuando el paciente queda con isquemia residual espontánea o inducida, debe ser llevado a angiografía y revascularizarse acordemente, ya que dejarlo con tratamiento médico incrementa el riesgo a corto y largo plazo, cuando se compara con la re vascularización.
ACTP tardía
Debe evitarse la dilatación de la arteria responsable cuando está ocluida y ya pasaron de 1 a 4 semanas del IMEST y el paciente no tiene isquemia residual en el territorio infartado.
VII. Grupos especiales
A) Angina postinfarto
Este término se utiliza para incluir un grupo de pacientes que presentan dolor precordial con características similares o parecidas al relacionado con el del infarto agudo del miocardio (IAM) dentro de las primeras semanas después del inicio de éste. En general se refiere a aquel dolor que aparece en el período de 24 horas y hasta dos semanas (30 días para otros autores) después del IAM. Cuando el dolor aparece dentro de las primeras 24 horas de iniciado el IAM, debe considerarse relacionado al IAM original.
El dolor precordial recurrente no necesariamente se debe a isquemia miocárdica, pero cuando está relacionada a ésta, existe evidencia sólida que la angina constituye un marcador de mal pronóstico, asociado a mayor incidencia de reinfarto y de mortalidad.332,335
El dolor puede estar condicionado también por pericarditis u otras etiologías no isquémicas. El dolor de pericarditis aparece usualmente después de las primeras 24 horas.
Otra causa de dolor recurrente post IAM son las complicaciones mecánicas como ruptura de la pared libre ventricular, del septum interventricular o ruptura de músculo papilar. Estas patologías suelen acompañarse de deterioro hemodinámico rápidamente progresivo e importante, que facilitan su identificación. El tratamiento está relacionado con la corrección quirúrgica del proceso.
Dentro de la angina postinfarto podemos tener pacientes con: Angina recurrente: que tiene características clínicas similares al dolor relacionado al IAM, aunque cabe mencionar que la mayoría de los episodios isquémicos post IAM, suelen no condicionar sintomatología y ser silentes.
Usualmente el dolor isquémico se presenta en reposo o con pequeños esfuerzos y puede, entonces estar o no relacionado con: a) trastornos electrocardiográficos que pueden ser depresión o elevación del segmento ST, inversión o pseudonormalización de la onda T; y b) elevación de los marcadores biológicos de daño miocárdico (CPK, CPK–MB). En el 10% de estos enfermos en los primeros 10 días puede sufrir un reinfarto, pero si éstos fueron sometidos a terapia trombolítica aunado a la ingesta de ácido acetilsalicílico, este porcentaje se reduce al 4%. El riesgo de reinfarto antes del primer mes se incrementó sobre todo en aquellos enfermos que presentaron alteraciones en el segmento ST acompañado de angina, y además se aprecia una mayor mortalidad en el subgrupo de enfermos que presentan alteraciones hemodinámicas durante el episodio de dolor recurrente,94,336,341 y Angina refractaria: definida como la presencia de dolor anginoso repetitivo, no controlado con tratamiento farmacológico óptimo y que puede acompañarse de inestabilidad hemodinámica o no, pero que conlleva la necesidad de colocación de balón de contrapulsación aórtico. Independientemente de si el enfermo ha sido o no reperfundido y aparece angina en las primeras 24 horas, éste deberá ser sometido a coronariografía diagnóstica (Tabla XX). Una vez realizada deberá seleccionarse el método de revascularización más apropiado para cada caso. Hay que entender que estos pacientes presentan diversos grados de gravedad y por otro lado que algunos fueron sometidos a revascularización con trombolíticos y otros a ACTP. La urgencia del procedimiento a seguir (ACTP, cirugía, retrombólisis) debe ser siempre individualizada.

La terapia médica no difiere a la empleada en el paciente con angina inestable. Son aspectos fundamentales una óptima anticoagulación con heparina ya sea fraccionada o no (Tabla XX). Es también importante la terapia antiplaquetaria y pudiera ocupar un lugar importante el empleo de inhibidores de glucoproteína IIb/IIIa.342 Estos pacientes deben recibir terapia con nitroglicerina y beta–bloqueadores intravenosos.343 Se recomienda la reperfusión inmediata utilizando: 1. Retrombólisis especialmente, ante la presencia de trombo, 2. ACTP coronaria si el tipo de lesión lo permite o 3. Cirugía de Re vascularización miocárdica (CRVM) en aquellos sujetos con enfermedad de múltiples vasos o lesiones complejas. Deberá considerarse el empleo del balón de contrapulsación intra–aórtico, dado que hasta el 10% de estos enfermos se benefician con su utilización como puente para la revascularización, especialmente en aquellos sujetos con arritmias, insuficiencia cardíaca o persistencia de los síntomas a pesar del tratamiento farmacológico óptimo.344
Se considera como retrombólisis la re–administración de un agente trombolítico dentro de los 15 días posteriores al uso de uno previo.128,345 De preferencia deberá emplearse alteplase para este fin y se sugiere el no uso de estreptoquinasa si fue éste el primer trombolítico empleado.
Las arritmias que acontecen durante la isquemia recurrente, deberán ser manejadas en forma similar a las que se presentan durante el IAM. En la Tabla XX se resumen el manejo de todo paciente con isquemia recurrente postinfarto.
B) Pericarditis
Desde el punto de vista clínico el dolor torácico suele ser continuo, relacionado con los movimientos respiratorios y con la posición del enfermo. Es la segunda causa del dolor precordial post IAM, observada en el 25% de los pacientes con infarto transmural340,346 no trombolizado, suele ser indicativo de infarto de gran extensión con daño ventricular importante347,348 por lo que se considera un indicador de mal pronóstico. Se ha demostrado que los métodos de reperfusión han disminuido su incidencia.80,349La presencia de pericarditis en el paciente bajo tratamiento anticoagulante con heparina obliga a una vigilancia más estrecha, por el riesgo de aparición de tamponamiento cardíaco. Clínicamente existe la presencia de frote pericárdico en el 20% de los pacientes, usualmente no se manifiestan con compromiso hemodinámico y es posible detectar derrame pericárdico por medio de ecocardiografía en más del 40% ,350 En la mayoría de los enfermos con IAM es posible detectar pequeños derrames pericárdicos sin que esto indique pericarditis. La utilidad del electrocardiograma en el diagnóstico de pericarditis relacionada al IAM es limitada. El ecocardiograma y la ausencia de alza enzimática son mejores ayudas para su confirmación. Como parte del manejo terapéutico el uso del ácido acetilsalicílico a dosis que fluctúan desde 325 mg en 24 horas y de acuerdo a la respuesta hasta dosis 650 mg cada 4 a 6 a horas,351,352 el uso de la indometacina en estos enfermos no es recomendable, y por otro lado, aunque se han utilizado corticosteroides e ibuprofeno éstos pueden incrementar el riesgo de ruptura cardíaca (Tabla XXI). Ante la evidencia de repercusión hemodinámica por tamponamiento cardíaco debe suspenderse toda terapia antitrombótica y realizar pericardiocentesis. Se considera al síndrome de Dresler como una pericarditis autoinmune de aparición tardía (entre la primera y décima semana post IAM) y su frecuencia se ha reducido con el uso de las terapias de reperfusión. Éste suele presentarse con afectación sistémica importante, fiebre, leucocitosis, y elevación de marcadores plasmáticos de inflamación aguda. El tratamiento es a base de ácido acetilsalicílico a dosis elevadas.16
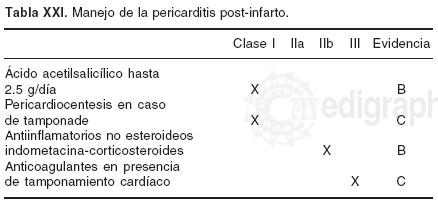
C) Manejo del paciente con disfunción ventricular
La disfunción ventricular izquierda (DVI) como complicación del IMEST ocurre en aproximadamente un 15–25% de los pacientes y está asociado con un pronóstico pobre a corto y largo plazo, en algunos estudios se han reportado una mortalidad hospitalaria del 15–40% y del 25–55% a un año.80,353,357 Las características clínicas pueden ser diversas, relacionadas a la gravedad, pero las más frecuentes son: disnea, taquicardia sinusal, un tercer ruido cardíaco, y estertores pulmonares inicialmente básales, que pueden ser generalizados a ambos campos pulmonares, hasta un pulso débil, pobre perfusión periférica, obnubilación y oliguria. En etapas muy tempranas del infarto las manifestaciones de falla de bomba pueden ser muy sutiles, por lo que es fundamental la correcta y rápida detección de los signos de afectación hemodinámica. La disfunción ventricular derecha (DVD) ha sido demostrada en algunos estudios,358 como un predictor independiente de mal pronóstico, incluyendo muerte y el desarrollo de insuficiencia cardíaca, en pacientes con DVI después del infarto. Se han propuesto algunos mecanismos como posibles etiologías para explicarlo: La disfunción ventricular izquierda es un precursor importante de la disfunción ventricular derecha359 en donde el ventrículo derecho es extremadamente sensible a cambios en la postcarga, como lo es el aumento de la presión auricular izquierda,360 sin embargo otros estudios361,362 sugieren que la DVD es independiente del grado de DVI, y está más relacionado a la localization y extensión del infarto. El infarto ventricular derecho complica aproximadamente el 50% de los casos de IAM inferior, pero la disfunción ventricular derecha frecuentemente acompaña a infartos de otra localization diferente a la inferior.363,364 Se ha propuesto por ello, que la función del ventrículo derecho después de un infarto debe ser estimada dentro de la evaluación del paciente sobre todo cuando existe DVI. En varios estudios se ha utilizado la clasificación Killip365 como un indicador pronóstico de sobrevida después del IAM. Esta clasificación está basada en parámetros clínicos, lo que limita su empleo para detectar adecuadamente alteraciones debidas a disfunción ventricular derecha. No obstante la mejor opción terapéutica en presencia de disfunción del VI es aquella que utiliza los parámetros hemodinámicos específicos que estén presentes: 1) presión capilar pulmonar en cuña, 2) gasto cardíaco (medido por un catéter balón de flotación) y 3) presión arterial sistémica (medida preferiblemente con un catéter intraarterial). Por lo que se han propuesto clasificaciones como la de Forrester366 para guiar el tratamiento.
1. Disjunción ventricular leve–moderada
Frecuentemente los pacientes tienen un índice cardíaco menos de 2.5 L/min/m2, la presión de llenado del lado izquierdo modestamente elevada (mayor de 18 mm Hg), y una presión arterial sistólica de 100 mm Hg o menor. En estos casos el oxígeno debe administrarse tempranamente por mascarilla o intranasal, teniendo precaución en pacientes con enfermedad pulmonar crónica, por lo que es recomendable realizar monitorización continua de la saturación de oxígeno. Grados leves de falla cardíaca (correspondientes al Grado II de la clasificación de Killip) responden adecuadamente a diuréticos (furosemida intravenoso) conjuntamente con reducción de la postcarga y la precarga usando nitroglicerina o nitratos orales. La nitroglicerina intravenosa ofrece un adecuado grado de venodilatación y mejora la isquemia dilatando las arterias coronarias epicárdicas. En las primeras horas del infarto, cuando la isquemia contribuye sustancialmente a la disfunción ventricular, la nitroglicerina es el agente más apropiado. Puede ser iniciada una infusión intravenosa a 5 µg/min e incrementar gradualmente hasta una caída de la presión arterial media de 10 al 15% pero no debajo de 90 mm Hg. En circunstancias más severas con edema de pulmón franco (Grado III de la clasificación de Killip) en que no responden adecuadamente a las medidas previas es posible asociar otros vasodilatadores como el nitroprusiato. El inicio de terapia con IECA está indicado dentro de las primeras 48 horas, en ausencia de hipotensión arterial, hipovolemia o insuficiencia renal significativa.
2. Disfunción ventricular severa
Los pacientes con este grado de disfunción, generalmente tienen un volumen cardíaco deprimido, una presión de llenado anormalmente alta, y una presión arterial sistólica de menos de 90 mm Hg; este paciente tiene, o está rápidamente acercándose, a un choque cardiogénico. Si el paciente está marcadamente hipotenso, puede ser administrada norepinefrina intravenosa, hasta que la presión arterial sistólica se eleve por lo menos a 80 mm Hg, en este momento puede cambiarse a dopamina, iniciando a dosis de 2.5–5 µg/kg/min. Una vez que la presión sistólica se encuentre a por lo menos 90 mm Hg o si la congestión pulmonar es dominante puede iniciarse dobutamina a dosis de 2.5 µg/kg/min (Tabla XXII).
D) Choque cardiogénico
El choque cardiogénico es un estado de hipoperfusión tisular debida a disfunción cardíaca, usualmente por IAM39 caracterizado por presión arterial sistólica < 90 mm Hg y PCP > 20 mm Hg, o IC < 1.8 L/min.38 El choque circulatorio es manifestado por hipotensión y signos clínicos de mala perfusión tisular, incluyendo oliguria, alteración del sensorio, y extremidades frías y amoratadas y es diagnosticado al documentar la disfunción del miocardio y excluyendo o corrigiendo factores como hipovolemia, hipoxia y acidosis.
La causa más común de choque cardiogénico es el IAM extenso, aunque aparentemente pequeños infartos en un paciente con compromiso previo de la función ventricular izquierda puede precipitar el choque. Estudios recientes han estimado la incidencia del choque cardiogénico en pacientes infartados desde un 5–10%. Algunos estudios han mostrado una incidencia de choque cardiogénico en el paciente con IAM del 7.2 al 7.5%, lo que además ha permanecido sin modificaciones importantes desde hace 20 años.122,370 Las causas mecánicas del choque cardiogénico incluyen: ruptura septal ventricular, regurgitación mitral aguda severa y tamponamiento cardíaco, siendo la primera de éstas la que ha sido asociada con una mortalidad significativamente más alta que cualquiera de las otras categorías.369,370 El choque cardiogénico en presencia de IAM, aparece con incidencia mayor en pacientes ancianos, diabéticos e infartos de localization anterior; esta última hasta en un 46% de los casos.371,372 Estos pacientes tienen además con mayor frecuencia historia de enfermedad vascular periférica y enfermedad cerebrovascular. 365,372,373 .Una fracción de expulsión considerablemente disminuida y niveles de enzimas cardíacas muy elevadas son también predictores de choque cardiogénico.372,373 El choque cardiogénico continúa siendo la principal causa de muerte en pacientes hospitalizados con IAM.374 Dentro del enfoque inicial de manejo del paciente con choque cardiogénico, debe ser rutinario el uso de catéter para monitoreo de la presión venosa central, acceso arterial y oximetría de pulso. En algunas ocasiones es necesario la intubación endotraqueal para mantener una adecuada oxigenación y protección de la vía aérea. Es importante corregir las alteraciones electrolíticas y ácido base que estén presentes. El alivio del dolor y la ansiedad con sulfato de morfina o fentanil (si la presión sistólica está comprometida) reduce la actividad simpática excesiva y con ello disminuye la demanda de oxígeno, la precarga y la postcarga. Las arritmias y bloqueos cardíacos pueden comprometer importantemente el gasto cardíaco por lo que deben ser corregidas tempranamente con antiarrítmicos, cardioversión o marcapaso, según sea el caso. En pacientes con adecuado volumen intravascular e hipoperfusión tisular, debe iniciarse soporte cardiovascular con agentes inotrópicos como la dopamina y dobutamina. La dobutamina puede mejorar la contractilidad miocárdica e incrementar el gasto cardíaco sin cambios significativos sobre la frecuencia cardíaca y la resistencia vascular sistémica, siendo éste el agente de elección en el paciente con presión sistólica mayor de 80 mm Hg.375–377 La dobutamina puede exacerbar la hipotensión y precipitar taquiarritmias en algunos pacientes. La dopamina tiene ambos efectos, inotrópico y vasopresor, por lo que es preferible en presencia de una presión sistólica menor de 80 mm Hg.378,379 En algunas situaciones especiales, la combinación de ambos agentes inotrópicos puede ser más efectiva, que cualquiera de ellos solos.380 En estados de hipotensión refractaria, la norepinefrina puede ser necesaria para mantener la presión de perfusión a los órganos.381 El monitoreo hemodinámico invasivo es extremadamente útil en la optimización terapéutica de los pacientes inestables, ya que las estimaciones clínicas de la presión de llenado pueden ser poco confiables (Tablas XXIII y XXIV). Las mediciones más confiables de la presión de llenado, gasto cardíaco y otras mediciones, permiten el ajuste adecuado de los agentes inotrópicos y vasopresores a las dosis mínimas necesarias requeridas para obtener las metas terapéuticas y con ello disminuir la demanda miocárdica de oxígeno y el potencial arritmogénico.382 Los diuréticos deben ser usados para tratar la congestión pulmonar. Los vasodilatadores, tales como la nitroglicerina y el nitroprusiato, deben ser usados con precaución, debido al riesgo de precipitar o exacerbar la hipotensión y disminuir el flujo sanguíneo coronario, aunque ambos agentes pueden ser administrados bajo supervisión hemodinámica invasiva continua. Los beneficios de la terapia trombolítica en pacientes con choque cardiogénico presente desde su admisión hospitalaria es poco clara. Esto es debido a que los estudios realizados sobre terapia trombolítica, excluyen a los pacientes con choque cardiogénico, por lo que son pocos los estudios que han demostrado que reduce la mortalidad en pacientes con choque cardiogénico establecido. Lo que es claro es que la trombólisis reduce la probabilidad de desarrollar choque cardiogénico después de la presentación inicial.85,94,122,384 Esto es importante debido a que muchos pacientes presentan choque cardiogénico hasta después de 6 horas de su admisión hospitalaria.122,383En el estudio GISSI se reportó una mortalidad a 30 días del 69.9% en pacientes con choque cardiogénico que recibieron estreptoquinasa y de 70.1% en el grupo placebo. Las posibles razones de la pobre eficacia trombolítica en pacientes con choque cardiogénico, tal vez sean hemodinámicas, mecánicas y metabólicas, ya que la presión arterial disminuida limita la penetración del agente trombolítico hacia el trombo y la acidosis puede inhibir la conversión de plasminógeno a plasmina. En el estudio SHOCK se reportó una mortalidad total en pacientes con choque cardiogénico de hasta 60%, el cual es menor que en estudios previos reportados.368 Esto es explicado quizás por la mayor utilización de balón de contrapulsación intra–aórtico y revascularización.385 Estudios no aleatorizados han reportado una baja mortalidad con trombólisis y balón de contrapulsación como terapia combinada386,387 (Tabla XXV). Otros estudios retrospectivos recientes, no aleatorizados han sugerido que la reperfusión mecánica por ACTP o cirugía de revascularización de la arteria ocluida puede mejorar la sobrevida de los pacientes con IAM y choque cardiogénico. En un análisis de un subgrupo del estudio GUSTO–1122 mostró que la mortalidad a 30 días fue significativamente más baja en pacientes tratados con ACTP (43% comparado con 61% de los pacientes con choque a su llegada al hospital y 32% comparado con 61% de los pacientes que posteriormente lo desarrollaron. En otra serie de casos, la reperfusión mecánica con ACTP ha reportado porcentajes de sobrevida en hospital hasta de un 70%. Un estudio multicéntrico, aleatorizado, prospectivo ha confirmado este enfoque.367 El papel de la terapia antiplaquetaria adjunta como los inhibidores de la Gp lib/ Illa han mostrado mejorar los resultados clínicos a corto plazo después de ACTP. Publicaciones recientes de experiencia con inhibidores Gp IIb/IIIa en pacientes con choque cardiogénico sugieren que juegan un importante papel como terapia adjunta en pacientes sometidos a ACTP.388 La cirugía de revascularización de emergencia se ha utilizado cuando otras intervenciones han fallado o están contraindicadas. Datos desde el estudio SHOCK sugiere que en algunos pacientes, está asociada con baja mortalidad (19%) en comparación con ACTP de emergencia (mortalidad del 60%) en pacientes con IAM complicado con choque cardiogénico, en donde estarnas claramente definida la eficacia de la cirugía de revascularización en este grupo de pacientes.367 Basado en estos estudios iniciales, la consideración de CABG de emergencia puede ser para pacientes con IAM y enfermedad severa, difusa y multivaso y en quienes no son candidatos o en quienes ha fracasado la terapia trombolítica y/o ACTP, y quienes están dentro de 4–6 horas de inicio de IAM. En el caso de los pacientes con choque cardiogénico en quienes la anatomía coronaria no es adecuada para ACTP, la ventana de tiempo puede extenderse a 18 h del inicio del choque.

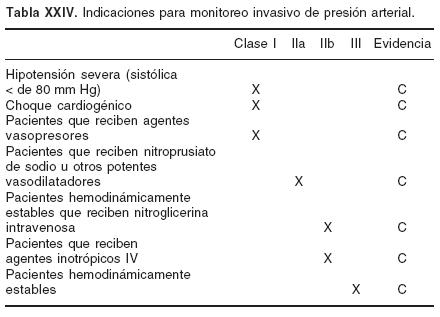

E) Monitoreo hemodinámico
1. Catéter de flotación en la arteria pulmonar
El catéter de flotación es a menudo muy útil en el manejo del IAM con inestabilidad hemodinámica concomitante, incluyendo el bajo gasto cardíaco, la hipotensión aguda, taquicardia persistente, el edema pulmonar, y el choque cardiogénico establecido (Tabla XXIII). En el paciente con la hipotensión y taquicardia, el catéter de flotación permite la diferenciación rápida y fácil de; a) volumen intravascular inadecuado, con la resultante caída en la presión de llenado diastólico ventricular izquierdo, y b) de volumen intravascular adecuado con la presencia de una presión de llenado ventricular izquierdo alta debido a la disfunción extensa del ventrículo izquierdo. El tratamiento de la primera es la expansión rápida del volumen intravascular (es solución salina normal) mientras que el manejo de la última consiste en el empleo de diuréticos, soporte inotrópico, reducción de postcarga con vasodilatadores y tal vez otras medidas de soporte ventricular. En aquellos pacientes con disfunción ventricular grave, el catéter con balón de flotación en el lado derecho del corazón puede emplearse también para monitorear los esfuerzos terapéuticos ajusfando continuamente la presión de llenado ventricular izquierdo así como maximizar el gasto cardíaco al nivel más bajo posible de presión de llenado. Estas manipulaciones sofisticadas de las presiones intracardíacas y del gasto cardíaco son usualmente hechas en forma considerablemente más fácil con la información que ofrece el catéter de flotación. Aunque el catéter de flotación es seguro cuando se emplea por operadores experimentados, su uso se ha relacionado con eventos adversos incluyendo taquiarritmias ventriculares (durante su manipulación) y hemorragia o infarto pulmonar. Por otro lado, causa algunas molestias al paciente y requiere que el paciente se encuentre relativamente inmóvil. Dado que la curva de presión registrada por el catéter puede fácilmente distorsionarse, el médico debe rutinariamente examinar su morfología que le asegure se encuentra colocado en posición correcta. Dada la posibilidad de infección, el catéter no debe permanecer en su sitio más de 5 días. En la 17 se resumen las principales indicaciones del catéter de flotación.
2. Balón de contrapulsación intra–aórtico
Desde su introducción a finales de los sesenta el balón de contrapulsación intra–aórtico ha sido reconocido como un tratamiento efectivo para pacientes con síndromes coronarios inestable y choque cardiogénico,389,393 sin embargo inicialmente fue ampliamente empleado para estabilizar a pacientes mortalmente enfermos con colapso hemodinámica.395,39 Actualmente, este dispositivo de asistencia ventricular, es rutinariamente usado en un amplio espectro de condiciones cardiovasculares graves (Tabla XXV), desde estabilización hemodinámica en pacientes que presentan complicaciones del IAM o choque cardiogénico, hasta pacientes de muy alto riesgo que son sometidos a ACTP o cirugía de revascularización coronaria.367,397,398
El principio fisiológico de la contrapulsación es una rápida disminución en la presión intra–aórtica, sincronizada con la expulsión del ventrículo izquierdo, seguida por un rápido incremento en la presión intra–aórtica durante la relajación isovolumétrica del ventrículo izquierdo. La impedancia para la eyección del ventrículo izquierdo está disminuida (descarga sistólica), disminuyendo la postcarga, y la presión diastólica está aumentada, lo cual mejora la presión de perfusión coronaria. Por lo tanto el trabajo del corazón es menor y la demanda miocárdica de oxígeno disminuye, con un concomitante incremento del aporte de oxígeno miocárdico.399,400 Esta combinación de efectos fisiológicos han hecho que el balón de contrapulsación sea un armamento poderoso en el manejo de los pacientes con síndromes coronarios agudos o choque cardiogénico. Actualmente en todas las estrategias del manejo del paciente con choque en que la contrapulsación se emplea, éste actúa como un sistema de estabilización o puente para facilitar la angiografía diagnóstica y la revascularización o reparación miocárdica. En poblaciones de pacientes seleccionados las frecuencias de sobrevida de choque cardiogénico tratado en las primeras 16 a 24 horas con balón de contrapulsación intra–aórtica y revascularización con ACTP o quirúrgica están alrededor de 60 al 75%392,401 de la misma forma el balón de contrapulsación aórtico empleado como soporte y reparación temprana de ruptura del septum intraventricular o de insuficiencia mitral muestra frecuencias de sobrevida del 60% o mayor.393 Pacientes con isquemia recurrente severa después de un infarto pueden estabilizarse con un balón de contrapulsación intra–aórtico y posteriormente ser llevados a angiografía y revascularización de emergencia con ACTP o cirugía.402 Pacientes con disfunción ventricular izquierda importante y enfermedad trivascular o enfermedad del tronco de la coronaria izquierda pueden también recibir beneficios del empleo del balón de contrapulsación en forma profiláctica, previo a angiografía, intervención percutánea o revascularización quirúrgica, debido a la alta probabilidad en estos pacientes de presentar eventos adversos durante dichos procedimientos. Las complicaciones o efectos adversos relacionados con el uso de este dispositivo, han sido más frecuentemente reportadas: isquemia mayor de la extremidad (0.9%) y hemorragia mayor (0.8%).403,404 La mortalidad hospitalaria del paciente con IAM que requirió de balón de contrapulsación varía enormemente, relacionada a la indicación principal del uso del dispositivo y el desarrollo de la revascularización coronaria. Está claro que la mortalidad es significativamente mayor en aquellos pacientes con IAM, que requirieron contrapulsación aórtica y que no les fue realizada la angiografía ni revascularización coronaria. En estudios recientes, tales como el Registro Benchmark405 y el estudio SHOCK406 se han reportado mortalidad hospitalaria del 38.7% y del 46.7% respectivamente. En ambos estudios se revascularizaron a > 80% de los pacientes. En los pacientes que no presentan disfunción del VI, el empleo rutinario y profiláctico del balón de contrapulsación intra–aórtica durante cualquier estrategia de reperfusión no es recomendable. En la Tabla XXV se enumeran las principales indicaciones para la utilización del balón de contrapulsación.
F) Infarto del ventrículo derecho
El infarto miocárdico con involucro del ventrículo derecho, generalmente se asocia a la oclusión proximal de la arteria coronaria derecha, que condiciona disfunción de la pared libre del ventrículo derecho, así como los inherentes trastornos hemodinámicos que pueden pasar inadvertidos clínicamente o hasta condicionar choque cardiogénico. La isquemia del ventrículo derecho puede ser demostrada en hasta la mitad de los enfermos con infarto de localization inferior, aunque solamente del 10 al 15% muestran anormalidades clínicas y hemodinámicas. Una función sistólica deprimida del VD reduce la precarga ventricular izquierda y así el gasto cardíaco. El VD isquémico es delgado, rígido, usualmente dilatado y dependiente de volumen, resultando en disfunción pandiastólica y alteraciones de la distensibilidad ventricular izquierda mediados por el septum que son exacerbadas por una presión intrapericárdica elevada. Bajo estas condiciones la generación de presión ventricular derecha y el gasto cardíaco son dependientes de las contribuciones contráctiles septales, gobernado tanto por la contracción septal primaria y el movimiento septal paradójico. En el infarto miocárdico inferior con extensión a VD la mortalidad es mayor (30%) en comparación aquellos pacientes sin extensión al VD (6%), la mortalidad está relacionada a la presencia o no de grave repercusión hemodinámica.
El espectro clínico del daño del VD debe ser sospechado por: hipotensión, pulmones claros y aumento del pulso yugular, en el contexto de un infarto inferior, la elevación del segmento ST en la derivaciones v3 y v4 derechas, dentro de las primeras horas, es muy sugestiva del diagnóstico, por este motivo en todo enfermo con choque cardiogénico deberán de registrarse las derivaciones electrocardiográficas cuando no se toman de manera rutinaria. En más de la tercera parte de estos pacientes puede aparecer fibrilación auricular,407 y otras arritmias como el paro auricular o bloqueos auriculoventriculares. La elevación de la presión intra–aricular derecha por arriba de 10 mm Hg o un 80% superior de la presión capilar pulmonar, son altamente sugestivos de disfunción ventricular derecha por infarto. El eco–cardiograma puede confirmar el diagnóstico por los siguientes hallazgos: 1. Dilatación ventricular derecha asociada a hipocinesia o acinesia, 2. Dilatación auricular derecha y 3. Insuficiencia tricuspídea, con regurgitación de baja velocidad. El análisis del movimiento anular ticuspídeo en estos sujetos puede ser un predictor independiente del pronóstico en pacientes con primer infarto con afectación del VD. A pesar de que usualmente los pacientes con infarto del VD son más jóvenes, presentan menor incidencia de infarto anterior y mayor prevalencia de enfermedad de un solo vaso, en comparación con aquéllos con grave disfunción ventricular izquierda y choque cardiogénico; cuando estos pacientes desarrollan choque cardiogénico del VD la mortalidad es similar en ambos grupos.408En el tratamiento (Tabla XXVI), deberá ser considerado algún procedimiento de reperfusión miocárdica de manera oportuna y eficaz, que han demostrado mejoría en la función ventricular derecha409 y reducción en la aparición de BAV completo. La base fundamental del tratamiento es el mantener la precarga del ventrículo derecho así como su postcarga, lo que condiciona mejoría en la precarga ventricular izquierda y así el gasto cardíaco. Esto se logra inicialmente con volumen y en caso necesario con soporte inotrópico. La instalación de inotrópicos, específicamente de dobutamina debe iniciarse rápidamente si no ha mejorado el gasto después de administrar uno a dos litros de solución salina isotónica. Es importante considerar que en estos enfermos el empleo de los diuréticos y nitratos, así como inhibidores de ECA y algunos agentes opioides pueden reducir el gasto cardíaco y producir hipotensión grave, motivo por el cual no deben emplearse. En estos sujetos el catéter de flotación es de gran ayuda para la monitorizar el comportamiento hemodinámico y verificar la respuesta al tratamiento. La fibrilación auricular deberá de corregirse de manera expedita, debido que la contribución del llenado ventricular es reducido por la ausencia de la contracción atrial. Por tal motivo ante la evidencia de compromiso hemodinámico importante debe realizarse la cardioversión eléctrica. Un factor importante para mantener la precarga ventricular derecha es una adecuada sincronía auricular ventricular, en casi la mitad de estos pacientes aparecen bloqueos AV de alto grado. La colocación de un marcapaso transitorio atrioventricular secuencial puede incrementar significativamente el gasto cardíaco y revertir el estado de choque410 sin embargo habrá que considerar, que en manos no experimentadas, este procedimiento pudiera asociarse en el incremento de arritmias ventriculares.

Si el daño miocárdico importante involucra al ventrículo izquierdo y éste condiciona una postcarga elevada para el ventrículo derecho lo cual trae consigo mayor disfunción ventricular derecha, deberá de mejorarse la función ventricular izquierda con las medidas usualmente empleadas para ello.
G) Pacientes diabéticos
La diabetes mellitus está asociada con una marcada mayor prevalencia de enfermedad arterial coronaria. Dependiendo de los métodos diagnósticos puede estar presente hasta en el 55% de los enfermos adultos con DM comparada con 2 a 4% de la población general.411 Esta entidad representa un factor de riesgo independiente para mortalidad y morbilidad.411,412 La mortalidad cardiovascular es más del doble en el hombre y del cuádruple412–414 en la mujer diabéticos, en comparación con los no diabéticos, siendo el pronóstico post IAM peor en estos pacientes.415–417,153 Una cuarta parte de los pacientes con IAM son diabéticos94,340 y el número va en aumento. En la etapa aguda del infarto del miocardio es común que exista deterioro metabólico importante. La hiperglucemia es un factor predictor independiente de la mortalidad por lo que debe de corregirse rápidamente con infusión endovenosa de insulina. Está asociado a una función microvascular inapropiada, lo que resulta en una mayor incidencia de fenómeno de no reflujo y así un mayor tamaño del IAM, con pérdida considerable de la función ventricular. Hay que recordar que gran parte de los pacientes diabéticos con IAM pueden tener síntomas atipicos y/o silentes, que pueden generar retraso en la administración de algún método de reperfusión, y así contribuir a un mal pronóstico.415,416,418 En estos pacientes, la insuficiencia cardíaca es más frecuente. El tratamiento farmacológico del IAM en el paciente diabético es en términos generales similar al realizado en el enfermo no diabético con IAM, sin embargo, dada la presencia de la patología metabólica, existen algunas particularidades que lo diferencian (Tabla XXVII). La utilidad de los agentes antiagregantes plaquetarios, como el ácido acetilsalicílico en estos pacientes es clara.58 Las heparinas de bajo peso molecular son de mayor utilidad que las no fraccionadas.64,419,420 Esto es más evidente en pacientes de alto riesgo.421 Los agentes bloqueadores del receptor IIb/IIIa han demostrado una reducción significativa de eventos cardiovasculares mayores, y reintervención sobre la arteria responsable del infarto, en los pacientes diabéticos sometidos con ACTP con Stent.422,423 En el paciente diabético no existe contraindicación para trombólisis salvo en aquellos pacientes con retinopatía grado III en quienes exista hemorragia vitrea reciente424 por riesgo de sangrado retiniano. El tratamiento con betabloqueadores es muy útil en estos pacientes, reduce la mortalidad considerablemente (37% vs. 13% en los no diabéticos), así mismo un efecto benéfico similar se ha apreciado en la incidencia de reinfarto miocárdico.425 Los agentes IECA en los pacientes DM con IAM condicionan una importante reducción de la mortalidad a corto plazo y de la aparición ulterior de insuficiencia cardíaca, incluso mayor que la observada en los no diabéticos.426,427 La mortalidad a largo plazo en el paciente DM con IAM puede ser reducida por la infusión de solución insulina–glucosa, seguida con insulina en multidosis428,429 la terapia con insulina es benéfica influenciando en todas las causas cardiovasculares de mortalidad, con particular impacto en reinfarto fatal e insuficiencia ventricular izquierda.428

H) Pacientes mayores de 75 años de edad
Para fines de la presente guía consideramos como paciente anciano al mayor de 75 años. La edad es reconocida como el predictor más importante a corto y a largo plazo en IAM. La mortalidad de estos pacientes con IAM es más alta que para los de menor edad.430–434 En el estudio GUSTO–I se describen tasas de mortalidad a 30 días de 3% en pacientes menores a 65 años, del 9.5% entre 65 y 74 años, de 19.6% entre 75 y 84 y de hasta el 30% en el grupo de mayores a 85 años.122 Estos pacientes tienen con mayor frecuencia enfermedad multivascular y mayor deterioro en la función ventricular con mayor morbi–mortalidad. Es además portador con mayor frecuencia de lesiones calcificadas, infarto previo, y condiciones de comorbilidad.435 La frecuencia de choque cardiogénico e insuficiencia cardíaca es mayor en este grupo de enfermos. Cuando se utiliza terapia trombolítica como método de reperfusión en estos pacientes es más frecuente el riesgo de hemorragia intracerebral,97,436–438 y por otro lado el intervensionismo coronario percutáaneo en el paciente anciano tiene mayor riesgo de complicaciones intraprocedimiento en comparación con el de menor edad.439 El intervencionismo temprano en los pacientes ancianos con choque cardiogénico no demostró beneficio comparado406 con el menor de 75 años (Tabla XXVIII). La terapia del infarto agudo en estos pacientes, en términos generales es similar al de los pacientes con infarto y menor edad. Sin embargo existen algunas particularidades diferentes en el manejo que habrá que tener en cuenta. La terapia de reperfusión puede mejorar la sobreviva, pero existen dudas de la efectividad de dicha terapia trombolítica, ya que en la población existe una mayor mortalidad. La evidencia del beneficio de la trombólisis en los ancianos es limitada. En un análisis de los principales estudios clínicos aleatorizados,107 la mortalidad a 35 días en el subgrupo de pacientes mayores a 75 años fue del 24.3% en los pacientes tratados con trombolíticos y del 25.3% en pacientes que no los recibieron. En cifras absolutas el beneficio de la trombólisis fue de 10 vidas salvadas por cada 1,000 pacientes tratados, pero el intervalo de confianza al 95% fue muy amplia, sugiriendo que dicha terapia puede ser tanto beneficiosa como perjudicial y adicionalmente la reducción del riesgo relativo de muerte fue tan sólo marginal (RR: 0.96; IC95: 0.88–1.05). Sin embargo como consecuencia de la alta incidencia de mortalidad en el IAM en ancianos, es recomendable utilizar algún método de reperfusión en estos pacientes a pesar de la controversia sobre el beneficio, utilidad y eficacia de este tratamiento. Por otro lado, el emplear como método de reperfusión la ACTP primaria, se ha observado una mayor reducción en la incidencia de los eventos coronarios adversos mayores, como muerte, reinfarto o hemorragia cerebral observados a los 30 días (9% para ACTP y 29% con trombólisis con stk) pero aún ésta tiene un riesgo incrementado en el paciente anciano (Tabla XXVIII), el tratamiento quirúrgico en este grupo de pacientes puede ser considerado, pero conlleva una mayor morbi–mortalidad principalmente en el período postquirúrgico inmediato siendo de mayor relevancia las infecciones, insuficiencia respiratoria y la falla ventricular izquierda entre otras.

I) Arritmias cardíacas y trastornos de conducción
Las arritmias y los trastornos de conducción son comunes durante un IMEST y van desde las extrasístoles ventriculares a la taquicardia ventricular, y de la fibrilación ventricular al bloqueo auriculoventricular completo; son potencialmente fatales y requieren de su resolución inmediata. A menudo estos trastornos son una manifestación de un problema subyacente grave, como isquemia persistente, insuficiencia cardíaca, alteración del tono autonómico, hipoxia, y desequilibrio hidroelectrolítico o ácido–básico que requieren de medidas correctivas. La necesidad del tratamiento y la urgencia del mismo dependen principalmente de las consecuencias hemodinámicas de la arritmia o trastorno de la conducción.
1. Arritmias ventriculares en fase hospitalaria
Las taquiarritmias durante el IMEST pueden ser causadas por reentrada, automatismo aumentado y actividad disparada. Las consecuencias metabólicas de la isquemia (hipercalcemia intracelular, acidosis, metabolismo lipídico anaeróbico y la producción de radicales libres) contribuye a la arritmogénesis durante el infarto. La salida de potasio intracelular que produce despolarización de la membrana es el más importante de estos efectos. Adicionalmente un incremento en el tono simpático aumenta la inestabilidad eléctrica y favorece las taquiarritmias. Mientras que un aumento del tono parasimpático en los infartos postero–inferiores predispone a las bradiarritmia pero puede proteger contra la fibrilación ventricular.
Ventriculares: Las taquiarritmias ventriculares ocurren temporalmente en:
Fase pre–hospitalaria, dentro de las primeras horas del IMEST las arritmias ventriculares son comunes y pueden ser mortales. La isquemia aguda puede causar fibrilación ventricular probablemente por un mecanismo de reentrada caótica originado en la región del infarto y en fase–hospitalaria, se presentan en las primeras 48 horas y son el resultado de automatismo anormal originado en las fibras de Purkinje.
a) Extrasístoles ventriculares
Las extrasístoles ventriculares son muy frecuentes durante esta etapa y pueden ocurrir como complejos multiformes con fenómeno de RT, en forma bigeminada, tripletas, y breves salvas de taquicardia ventricular no sostenida. Su valor como predictores de fibrilación ventricular es discutible en la actualidad, por lo que el tratamiento especifico con drogas antiarrítmicas no es recomendable. Aunque las extrasístoles ventriculares pueden desencadenar una fibrilación ventricular y su supresión con lidocaína reduce la incidencia de esta arritmia letal en la fase aguda del infarto agudo del miocardio, esta droga aumenta significativamente el riesgo de asistolia por lo que su uso profiláctico no se justifica.
Los esfuerzos para definir una población de alto riesgo que pueda beneficiarse de la profilaxis con lidocaína no ha tenido éxito y estudios recientes han demostrado que la presencia de las llamadas arritmias premonitorias (> de 5 EVs/ min, R/T, EVs multifocales, parejas y salvas) tiene pobre sensibilidad (58–60%), especificidad (41–45%) y valor predictivo positivo (4–8 %) para fibrilación ventricular.441
b) Taquicardia ventricular
La taquicardia ventricular es una arritmia potencialmente fatal. La definición de que taquicardia ventricular es la presencia de tres o más complejos ventriculares consecutivos a una frecuencia igual o mayor a 100 LPM engloba arritmias benignas y potencialmente fatales, por lo que es de utilidad limitada, es preferible clasificarla en:
Taquicardia ventricular no sostenida: la que dura menos de 30 segundos.
De acuerdo a la morfología de los complejos QRS, la taquicardia ventricular puede dividirse en: Monomórfica (todos los complejos en una derivación del ECG son de la misma morfología) Polimórfica (Complejos ventriculares de múltiples formas)
La taquicardia ventricular puede ser primaria cuando ocurre en ausencia de insuficiencia cardíaca o secundaria cuando es una complicación de la misma.
En ocasiones en presencia de isquemia aguda o de un bloqueo auriculoventricular completo complicando un infarto agudo del miocardio, la taquicardia ventricular es polimórfica, gira alrededor de su eje (taquicardia ventricular helicoidal). Cuando la taquicardia ventricular monomórfica es extremadamente rápida (más de 200 LPM) se le denomina flutter ventricular, una arritmia potencialmente letal que debe ser tratada como fibrilación ventricular. Es importante diferenciar una taquicardia ventricular verdadera de un ritmo idioventricular acelerado (sucesión de complejos ventriculares ectópicos a una frecuencia menor a 120 LPM), una arritmia considerada benigna y que puede servir como ritmo de escape durante períodos de bradicardia sinusal acentuada o sugerir un automatismo anormal de la fibras de Purkinje. Esta arritmia tiene un buen pronóstico, es favorecida por una terapia de reperfusión exitosa, es hemodinámicamente bien tolerada y no se asocia con taquicardia ventricular sostenida o fibrilación ventricular por lo que no requiere habitualmente de tratamiento. Excepcionalmente durante esta arritmia la pérdida de la sincronía atrioventricular puede tener importancia clínica por que el uso de atropina o la colocación de un marcapaso para estimular la aurícula puede estar justificado.
c) Fibrilación ventricular
La fibrilación ventricular no tratada es letal y es la causa de la mayoría de las muertes en el infarto agudo del miocardio principalmente en la fase prehospitalaria. Excepcionalmente puede revertir espontáneamente y hay que distinguir la fibrilación ventricular primaria que ocurre en ausencia de insuficiencia cardíaca o choque cardiogénico de la secundaria que es consecuencia de estas alteraciones hemodinámicas. El significado pronóstico para la sobrevida a largo plazo (primer año de seguimiento) de la fibrilación ventricular temprana que ocurre en las primeras 48 horas es distinto de la tardía (> 48 horas). Esta última es la única que pone en riesgo la sobrevida del paciente después del alta hospitalaria. Lo mismo sucede con la fibrilación ventricular primaria, la que si bien aumenta la mortalidad intrahospitalaria, que puede llegar a 10–20%, no afecta el pronóstico a largo plazo. La mortalidad intrahospitalaria de la fibrilación ventricular secundaria es mayor (38–56%) pero el pronóstico de los sobrevivientes de esta arritmia a largo plazo es similar al de los pacientes con igual grado de falla ventricular izquierda que no hicieron fibrilación ventricular. El manejo se resume en la Tabla XXIX.

2. Arritmias ventriculares en fase post–hospitalaria
La taquicardia y la fibrilación ventricular después de 48 horas en el curso de un IMEST tienen muy mal pronóstico y comprometen la sobrevida en el primer año de seguimiento. Se han desarrollado un gran número de estrategias para tratar de identificar a los pacientes que tienen un riesgo elevado de eventos tardíos.
a) Fracción de expulsión de VI: La función ventricular izquierda disminuida es el más importante predictor de muerte súbita cardíaca después de un infarto del miocardio y puede ser evaluada antes del egreso hospitalario con ecocardiografía, radioventriculografía o angiografía de contraste. Una fracción de expulsión igual o menor del 40% aun en ausencia de otros marcadores de riesgo incrementa el riesgo de muerte súbita en el primer año de seguimiento.
b) Monitoreo de Holter: Con esta técnica, realizada antes del egreso hospitalario se analizan la frecuencia y grado de complejidad de las arritmias ventriculares (extrasístoles ventriculares y taquicardia ventricular no sostenida). La presencia de extrasístoles ventriculares frecuentes (más de 10/hora) se asocia a una mayor mortalidad en los sobrevivientes de infarto al miocardio. El significado de la taquicardia ventricular no sostenida ha cambiado desde la introducción de la fibrinólisis, en la era pre–trombolítica esta arritmia era un factor de riesgo independiente de muerte súbita y total, incluso más importante que las extrasístoles ventriculares frecuentes. En estudios recientes los resultados son contradictorios, mientras que en algunos se mantiene su utilidad pronostica en otros no fue predictor independiente de mortalidad. Esto puede deberse a una modificación del sustrato arrítmico por el trombolítico o a una menor frecuencia de la arritmia, lo que ocasiona que sea menos útil como marcador pronóstico.
La asociación de taquicardia ventricular no sostenida y una baja fracción de expulsión del ventrículo izquierdo aumenta el riesgo de muerte súbita después de un infarto del miocardio, principalmente cuando en un estudio electrofisiológico se induce una taquicardia ventricular sostenida.
c) ECG de señales promediadas: En presencia de la fibrosis resultante de un infarto del miocardio la propagación del impulso eléctrico en la zona del miocardio destruida se enlentece y produce señales eléctricas tardías y de bajo voltaje que no son detectables en el electrocardiograma convencional y que se han denominado potenciales tardíos. Su detección con esta técnica de promediación de señales ha sido interpretado como expresión de un sustrato anatómico capaz de favorecer arritmias ventriculares por reentrada (taquicardia ventricular sostenida capaz de generar en fibrilación ventricular). La terapia trombolítica y la ACTP primaria reducen la incidencia de potenciales tardíos. El valor predictivo negativo (ausencia de potenciales tardíos) es muy alto, pero su presencia (valor predictivo positivo) difícilmente implica el riesgo de un evento arrítmico maligno en el primer ano de seguimiento.
d) Marcadores de modulación del sistema nervioso autónomo: En la actualidad el papel que desempeña el sistema nervioso autónomo en la mortalidad cardíaca súbita es bien reconocido. Las alteraciones en el balance simpático–parasimpático, con un predominio del primero respecto al segundo, han sido claramente relacionados con un aumento del riesgo para el desarrollo de arritmias ventriculares malignas. Diversas técnicas no invasivas han sido desarrolladas para valorar la influencia autonómica sobre el corazón. Entre ellas destacan: la variabilidad de la frecuencia cardíaca, la sensibilidad barorrefleja, la alternancia de la onda T y dispersión del intervalo QT. La variabilidad de la frecuencia cardíaca disminuida se correlaciona con la existencia de un balance alterado del sistema nervioso autonómico con un predominio de la actividad simpática con respecto a la parasimpática. Los equipos actuales de Holter cuentan con el programa que permite su análisis. Aunque la variabilidad de la frecuencia cardíaca disminuida es un predictor independiente de otros marcadores de riesgo no invasivos, su valor predictivo cuando es considerada por sí sola es modesto pero aumenta significativamente cuando se le combina con los otros predictores como la fracción de expulsión, los potenciales tardíos, y la ectopia ventricular llegando a alcanzar hasta un 50%. Es recomendable al igual que con los otros marcadores el analizar la variabilidad de la frecuencia cardíaca en registros de Holter de 24 horas una semana después del IMEST. Las otras técnicas mencionadas para medir la modulación autonómica sobre el corazón parecen ser más potentes para predecir la muerte súbita pero por ahora su uso está restringido a Centros donde se realiza investigación.
e) Estudio electrofisiológico: El estudio electrofisiológico permite mediante estimulación eléctrica programada el inducir una taquicardia ventricular sostenida en algunos pacientes que han sufrido un IMEST. Se considera que la inducción de esta arritmia en el Laboratorio de Electrofisiología permite predecir el riesgo de muerte súbita en primer año de seguimiento.
3. Recomendaciones terapéuticas
El manejo de las arritmias ventriculares en el IMEST depende del grado de compromiso hemodinámico asociado con la arritmia.
Las extrasístoles ventriculares aisladas, parejas, el ritmo idioventricular acelerado y las salvas de taquicardia ventricular no sostenida son bien toleradas y no requieren de tratamiento. La taquicardia ventricular monomórfica sostenida asociada con angina, edema pulmonar o hipotensión arterial (presión arterial menor de 90 mm Hg) debe ser inmediatamente tratada con un choque eléctrico sincronizado de 100 Joules (cardioversión eléctrica sincronizada). En ocasiones se hace necesario repetir las descargas con incremento progresivo de la energía hasta 360 Joules para su supresión. Es importante asegurarse de la sincronización para que la descarga eléctrica caiga en el QRS para lo cual puede ser necesario el modificar la posición de las paletas para encontrar la mejor configuración. Si la frecuencia ventricular de la taquicardia es muy rápida y la sincronización resulta imposible puede darse una descarga no sincronizada. Esta arritmia es muy sensible a la energía eléctrica por lo que ocasionalmente puede suprimirse y revertir a ritmo sinusal después de un golpe en el tórax, que equivale a una descarga eléctrica de 0.5 a 1.0 Joules. Sin embargo, esta práctica no es recomendada porque hay el riesgo de convertir la taquicardia ventricular a fibrilación ventricular. La taquicardia ventricular monomórfica: sostenida bien tolerada hemodinámicamente (no asociada con angina, edema pulmonar o hipotensión arterial (presión arterial menor de 90 mm de Hg) debe de ser tratada con alguno de los siguientes regímenes:
Lidocaíina: Dosis de carga: bolo IV de 1.0 a 1.5 mg/kg y bolos suplementarios de .5–.75 mg/kg cada 5 ó 10 min hasta un máximo de 3 mg/kg pueden ser necesarios. La dosis de carga debe ser seguida de una de mantenimiento de infusión de 2–4 mg/min (30–50 µg/kg x min) durante 6–24 horas.
Amiodarona: Dosis de carga 150 mg IV en 10 min, seguidos de una infusión de 1 mg x min durante 6 horas y después reducir a 0.5 mg/min por 24 horas.
Cardioversión eléctrica sincronizada iniciando con 50 Joules para lo cual es aconsejable una anestesia breve. Si la terapia farmacológica no fue exitosa hay que realizar una cardioversión sincronizada bajo anestesia y con la energía ya señalada para el tratamiento de la taquicardia ventricular con repercusión hemodinámica. Es muy importante corregir las causas reversibles que favorecen la irritabilidad ventricular tales como el uso de drogas simpaticomiméticas (dopamina, dobutamina, norepinefrina, amrinona, etc), hipoxemia, isquemia, hipokalemia, hipomagnesemia, acidosis, o la presencia de un catéter intracardíaco.
Taquicardia ventricular polimórfica: esta arritmia debe ser manejada resolviendo la isquemia miocárdica con terapias de reperfusión y el uso de betabloqueadores adrenérgicos y/o balón de contrapulsación intra–aórtica. La administración de amiodarona 150 mg en 10 min seguida de la infusión constante de 1 mg/min hasta 6 horas y posteriormente seguida por infusión de mantenimiento de 0.5 mg/min puede ser también de utilidad. La fibrilación ventricular debe ser tratada con un choque eléctrico no sincronizado utilizando una energía inicial de 200 Joules. Si esta terapéutica no tiene éxito, se aplica un segundo choque de 200–300 Joules y de ser necesario un tercero de 360 Joules. Cuando la fibrilación ventricular es refractaria a la desfibrilación eléctrica puede administrarse epinefrina 1 mg IV, lidocaína (1.5 mg/kg), amiodarona 150 mg IV, metoprolol 5 mg IV cada 2 min por tres dosis, atenolol 5 mg IV en 5 min, seguidos de 5 mg IV diez minutos después, esmolol 500 ugr/kg x min en 1 min, seguidos de 50 ugr/kg x min en 4 minutos, infusión de una solución polarizante de glucosa, insulina y potasio.
4. Arritmias supraventriculares
Las arritmias supraventriculares que complican el IMEST están comúnmente asociadas con factores tales como un tono simpático aumentado, isquemia auricular, remodelación auricular, insuficiencia cardíaca y pericarditis.
El manejo de estas arritmias requiere de una atención cuidadosa a cada una de estas influencias provocadoras.
a) Taquicardia sinusal
Una taquicardia sinusal persistente es deletérea en presencia de infarto agudo del miocardio debido al incremento de las demandas de oxígeno que impone el aumento de la frecuencia cardíaca. El pronóstico de una taquicardia sinusal refractaria es malo debido a que usualmente se asocia a infartos extensos. Su tratamiento debe incluir la búsqueda y corrección de los factores precipitantes. La fiebre debe ser suprimida con aspirina o acetaminofén. La ansiedad puede ser aliviada con sedación y opiáceos. El tratamiento de la insuficiencia cardíaca es el habitual en esta condición y cuando no se ha encontrado una causa específica de taquicardia sinusal el uso de betabloqueadores puede ser útil a menos que exista insuficiencia cardíaca o hipotensión arterial.
b) Fibrilación y flutter auricular
La prevalencia de fibrilación y flutter auriculares ocurren en el 10–20% de los infartos y aumenta con la edad. Los pacientes que desarrollas fibrilación auricular en presencia de un infarto agudo del miocardio de pueden presentar complicaciones tromboembólicas y tienen mayor mortalidad. La fibrilación auricular es más común en presencia de insuficiencia cardíaca debido a distensión de la aurícula izquierda producida por aumento de las presiones de llenado. En términos generales la mortalidad en pacientes con fibrilación auricular es atribuible a la insuficiencia cardíaca y es más pronunciada cuando la arritmia ocurre más de 12 horas de inicio del infarto. La fibrilación auricular ocurre más precozmente en presencia de un infarto posteroinferior que uno de localization anterior y es casi la regla en infartos auriculares, pericarditis del ventrículo derecho y en presencia de embolias pulmonares. La pérdida de la contribución de la contracción auricular al llenado ventricular izquierdo disminuye el gasto cardíaco. Al igual que con la taquicardia sinusal cuando esta arritmia persiste y no es tratada oportunamente puede causar extensión del infarto y deterioro clínico. Cuando se produce hipotensión arterial, insuficiencia cardíaca o angina, es imperioso realizar una cardioversión eléctrica inmediata (Tabla XXX). Una descarga inicial sincronizada de 200 Joules para la fibrilación auricular y de 50 a 100 Joules para el Flutter auricular son adecuados pero puede ser necesario el aplicar choques subsecuentes incrementando los niveles de energía. Después de la cardioversión deben sopesarse los posibles riesgos y beneficios del tratamiento antiarrítmico para evitar la recurrencia de nuevos episodios de flutter o fibrilación auriculares. Los pacientes que desarrollan fibrilación auricular en presencia de estabilidad hemodinámica deben ser tratados médicamente. El tratamiento debe enfocarse al control de la respuesta ventricular. Los betabloqueadores adrenérgicos constituyen la primera línea de tratamiento y si hay dudas sobre si el betabloqueador puede ser tolerado puede administrarse esmolol (un betabloqueador de acción ultracorta), otras alternativas terapéuticas incluyen el verapamil endovenoso (2.5–5 mg IV en dos minutos hasta un máximo de 20 mg pueden repetirse 5–10 mg después de 15–30 min). El uso de digoxina está indicado cuando hay datos de insuficiencia cardíaca pero su efecto tomaría horas para disminuir la conducción en el nodo auriculoventricular por aumento del tono vagal, en contraste, los betabloqueadores y los calcio–antagonistas mencionados actúan directamente sobre el nodo auriculoventricular. El tratamiento antiarrítmico para suprimir las recurrencias de flutter y fibrilación auriculares no ha sido críticamente evaluado en pacientes con IMEST. La amiodarona endovenosa en un estudio fue relativamente efectiva para convertir la fibrilación auricular a ritmo sinusal en presencia de infarto agudo.440 El uso de antiarrítmico de la clase 1 A (quinidina, flecainida y propafenona) conlleva al riesgo de proarritmias en presencia de isquemia y/o infarto. Aunque la dofetilida parece ser relativamente segura en pacientes postinfartados no hay datos que demuestren su seguridad y eficacia en el IMEST.442 En los pacientes que tienen fibrilación auricular sintomática recurrente a pesar del uso de betabloqueadores y calcioantagonistas puede estar justificada su prevención con antiarrítmicos, como la amiodarona. Flutter auricular es mucho menos común que la fibrilación durante el IMEST. Las opciones farmacológicas son las mismas que la fibrilación auricular aunque el control de la frecuencia ventricular es típicamente más difícil de obtener que en flutter auricular. Un flutter auricular puede ser terminado sobreestimulando (estimular a frecuencia mayor a la frecuencia auricular del flutter) la aurícula derecha con un marcapasos. Los pacientes con fibrilación y flutter auricular deben ser anticoagulados para prevenir complicaciones tromboembólicas, principalmente si la fibrilación auricular tiene más de 48 horas de inicio. Una vez convertida la fibrilación y el flutter auricular si las condiciones que precipitaron la arritmias persisten, es aconsejable mantener la anticoagulación al menos 6 semanas.

c) Taquicardia paroxística supraventricular
La taquicardia paroxística supraventricular durante el infarto agudo es muy rara. Y cuando ocurre suele ser transitoria aunque recurrente. La insuficiencia ventricular izquierda y el aumento del tono simpático parecen ser factores precipitantes. La forma más común de taquicardia paroxística supraventricular es la taquicardia por reentrada nodal auriculoventricular pero hay casos donde una taquicardia por reentrada auriculoventricular que utiliza una vía accesoria para el circuito de reentrada puede estar presente. A menudo las maniobras vagales terminan este tipo de taquicardias. Aunque la adenosina y el verapamil IV son muy útiles para tratar estas arritmias en pacientes sin infarto agudo al miocardio no hay estudios que demuestren su seguridad en presencia del mismo. La adenosina frecuentemente causa dolor precordial y el verapamil puede causar hipotensión arterial y está contraindicado en presencia de insuficiencia cardíaca. Los betabloqueadores adrenérgicos endovenosos son efectivos para terminar estas arritmias. La cardioversión eléctrica sincronizada rara vez es necesaria pero siempre es efectiva en pacientes con taquicardia paroxística supraventricular. D) Ritmos de la unión auriculoventricular. En presencia de bradicardia sinusal un ritmo de escape de la unión auriculoventricular con frecuencia de 35–60 latidos x min puede ocurrir. Este es más común en pacientes con infarto inferior y no conlleva un mal pronóstico. Si esta bradicardia causa hipotensión la frecuencia cardíaca puede acelerarse con atropina (0.5 –1 mg IV) o colocando un marcapaso temporal.
5. Bradiarritmias y bloqueos
Las bradiarritmias y bloqueos durante la fase aguda del infarto varían en etiología, pronóstico y manejo de acuerdo con el sitio del infarto.
a) Bradicardia sinusal
La bradicardia sinusal ocurre en 10–41% de los infartos agudos al miocardio y es más común en los infartos postero–inferiores y su incidencia es mayor en pacientes tratados previamente con betabloqueadores. El manejo depende de la presencia de síntomas como hipotensión, angina, insuficiencia cardíaca o arritmias ventriculares que la acompañan. Una bradicardia aislada sin compromiso hemodinámico no debe ser tratada pues su pronóstico es bueno. Medicamentos como la morfina y la nitroglicerina ocasionalmente pueden producir reacciones vasovagales con hipotensión arterial y bradicardia que responden bien a la administración de una carga de líquidos endovenosos. Cuando la bradicardia sinusal produce síntomas y/o compromiso hemodinámico (frecuencia cardíaca menor de 50 latidos por minuto) se debe administrar atropina endovenosa en una dosis de 0.5–1 mg (Tabla XXXI). En ocasiones se han reportado en la literatura fibrilación ventricular inducidos por atropina.

Una bradicardia sinusal que ocurre más de 6 horas después del comienzo del infarto a menudo es transitoria pero puede ser causada por disfunción del nodo sinusal, infarto e isquemia auricular más que hiperactividad vagal por lo que responde menos a la atropina. En este caso si la bradicardia es sintomática hay que colocar un marcapaso preferencialmente en la aurícula derecha si la conducción auriculoventricular está intacta. El uso de isoproterenol debe evitarse porque este agente aumenta las demandas de consumo de oxígeno miocárdico y puede aumentar el tamaño del infarto.
b) Bloqueo auriculoventricular
El bloqueo auriculoventricular es común en el infarto agudo al miocardio (6–14%) e incrementa el riesgo de mortalidad intrahospitalario pero es un pobre predictor de mortalidad a largo plazo en los pacientes que sobreviven.
Los trastornos de la conducción intraventricular en la era pretrombolítica ocurrían en el 10–20% de los pacientes y en los estudios actuales de trombólisis ocurre en el 4% y predicen un incremento en la mortalidad hospitalaria.6
La mortalidad asociada con bloqueos y trastornos de la conducción intraventricular está relacionada más bien con la extensión del daño miocárdico que con el trastorno de la conducción. El pronóstico del bloqueo auriculoventricular se relaciona con el sitio del infarto, de tal manera que la colocación de un marcapaso no ha demostrado claramente una reducción en la mortalidad (Tabla XXXII).

El bloqueo auriculoventricular de primer grado es más común en el infarto al miocardio inferior y generalmente obedece al aumento de la actividad vagal sobre el nodo AV y no requiere tratamiento. Su presencia contraindica el uso de betabloqueadores o calcioantagonistas. El bloqueo AV de 2do grado Mobitz I también es más común en el infarto postero–inferior y es generalmente bien tolerado, sólo debe de ser tratado cuando es sintomático. Inicialmente se debe administrar atropina 0.5–1 mg IV y sólo cuando no hay respuesta debe colocarse un marcapaso temporal. El bloqueo AV de 2do grado Mobitz II conlleva a un riesgo mayor, es más común en el infarto anterior y debe de ser tratado con marcapaso temporal. En los pacientes con infarto al miocardio inferior el bloqueo es típicamente intranodal de tal manera que progresa de bloqueo de primer grado a bloqueo AV de 2do grado Mobitz I y a bloqueo AV completo, el ritmo de escape es de la unión AV y de QRS angosto y responden a la atropina. En los infartos anteriores el bloqueo está usualmente dentro o debajo del haz de His, el ritmo de escape es con QRS ancho y no responde a la atropina. En estos pacientes con infarto anterior es más común que el bloqueo completo sea precedido de un bloqueo de rama que de un bloqueo AV de menor grado. El bloqueo auriculoventricular de tercer grado debe ser siempre tratado con marcapaso temporal independiente de la sintomatología. En la Tabla XXXIII se resumen la incidencia, progresión e indicaciones de marcapasos temporales en los bloqueos auriculo–ventriculares.
c) Trastornos de conducción intraventricular
Los trastornos de conducción intraventricular son más frecuentes en los infartos anteriores y reflejan infartos extensos y se asocian con una alta mortalidad intrahospitalaria. En la Tabla XXXIV se resumen la incidencia de trastornos de la conducción intraventricular, su progresión y manejo.
6. Indicaciones para marcapaso definitivo en el infarto agudo
Todo paciente con bloqueo auriculoventricular sintomático independientemente del sitio de la lesión debe de recibir un marcapaso permanente (Tabla XXXV). Lo mismo está indicado en todo paciente que tenga bloqueo AV de segundo grado persistente con lesión en el sistema His Purkinje con bloqueo de rama del haz de His bilateral o bloqueo auriculoventricular completo (Clase I). La colocación del marcapaso permanente también está indicada en los pacientes con bloqueo de 2do grado transitorio que se asocien con bloqueo de rama del Haz de His (Clase I). El bloqueo auriculoventricular de 2do o 3er grado persistente y avanzado con lesión en el nodo AV está considerado como indicación Clase II, pero su utilidad no ha sido demostrada en pacientes asintomáticos. Es recomendable realizar un estudio electrofisiológico cuando el sitio de la lesión responsable del trastorno no ha sido precisado.
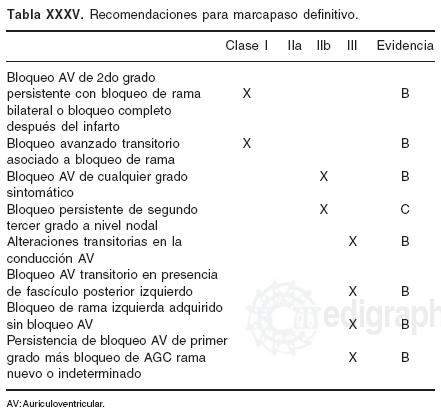
No se justifica la colocación de un marcapaso permanente en las siguientes condiciones.
1. Trastornos de la conducción AV transitorios en la ausencia de defectos de la conducción intraventricular.
2. Bloqueo AV transitorio en presencia de un BSARIHH aislado.
3. BSARIHH en ausencia de bloqueo AV.
4. Bloqueo AV de ler grado persistente en la presencia de BRHH que es preexitente o edad indeterminada.
7. Indicaciones de cardioversor/desfibrilador implantable
La utilidad del tratamiento con cardioverter desfibrilador implantable (CVI) en el contexto de IMEST ha sido evaluado en múltiples estudios. Actualmente el CVI es la terapia más efectiva para la prevención de muerte por arritmias ventriculares, sin embargo la naturaleza invasiva del tratamiento y el alto costo del tratamiento hace inapropiado su uso indiscriminado.
La utilización de estudios diagnósticos que pretenden encontrar a los pacientes que se beneficien más con la terapia con CVI demuestran que la fracción de eyección del ventrículo izquierdo es el parámetro más eficaz para elegir a los pacientes con alto riesgo de muerte por arritmia (MA) FE < 30% (Mortalidad de 20% en dos años). El estudio ATRAMI443 demostró que la disfunción autonómica evaluado con SDNN (Desviación estándar de intervalos R–R normales) < 70 ms o disminución de la actividad barorrefleja (BRS) < 3.0 ms/mm Hg en pacientes pos IAM es una medida eficaz para detectar pacientes con alto riesgo de MA. Estos parámetros combinados con una FE menor de 30% tuvieron una mayor eficacia para detectar pacientes con alto riesgo de muerte deprimida. Los estudios de prevención primaria con implante de un CVI en pacientes sobrevivientes de IAM mostraron una reducción de la mortalidad en general ( MADIT I444 24 vs 16%; MUSTT445 55 vs 24%; CABG Match446 24 vs 27%; MADIT II44719.8 vs 14.2%). Los estudios COMPANION448 Y SCH H e FT449 en pacientes con insuficiencia cardíaca , FE < 35% y QRS > de 120 ms; que una utilizó una terapia conjunta de CVI más resincronización cardíaca demostraron beneficio de esta terapia en pacientes isquémicos reducción de mortalidad general de 27% en COMPANION y de 21 % en SCH H e FT. El estudio DINAMIT450 que incluyó pacientes post IAM de 6 a 40 días después del evento con FE < 35%, SDNN < 70 ms o frecuencia cardíaca media < 750 ms (80 lpm) por holter. Reportó una mortalidad total de 6.9% en grupo control contra 7.5% en grupo de CVI, pero al analizar las muertes por arritmia se encontró una mortalidad de 3.5% en grupo control contra 1.5% en grupo CVI. La mortalidad general fue superior en grupo de CVI por las muertes no arrítmicas.451
El estadio Madit II incluyó pacientes con un mes post IAM ó 3 meses post CABG con FE < 30% y QRS superior a 120 ms. Los resultados mostraron una reducción de la mortalidad general de 31% y una reducción de 67% de muerte súbita en el grupo de CVI. La utilización de estrategias invasivas (Estudio electrofisiológico) para distinguir entre pacientes de riesgo alto no demostró diferencias significativas en el resultado final. (MADIT I, MUSTT).
Por tanto la decisión final de implantar un Cardioverter desfibrilador implantable (CVI) en un paciente sobreviviente de un infarto agudo del miocardio (Tabla XXXVI). Un mes post IAM o tres meses posterior a cirugía de revascularización miocárdica (CABG) debe ser basada en las características de cada paciente; el manejo de antiarrítmicos en la fase aguda es recomendado; después de un mes post IAM el paciente debe ser evaluado para categorizar el riesgo de muerte por arritmia.

VIII. Tratamiento quirúrgico
A) Generalidades
El tema, que es la cirugía de revascularización en el infarto agudo del miocardio, es un tema controversial en el cual las distintas guías publicadas establecen en forma limitada la participación de la cirugía de revascularización coronaria en la etapa aguda del infarto del miocardio, siendo en algunas de las guías minimizada y declarada como nula su participación. Esta posición no fue aceptada por los integrantes de la mesa, siendo que se considera que la cirugía continúa siendo útil en un subgrupo especial de pacientes, con un nivel de evidencia I–B.
Esto es que se considera que la cirugía de revascularización puede ser aplicada en condiciones particulares, siendo útil y efectiva para los pacientes que sufren de un infarto de miocardio durante las primeras horas de su evolución,452,453 existiendo para establecer esto, evidencia bibliográfica en un número de estudios aleatorizado con pequeño número de pacientes y registros observacionales que lo avalan.454,455
La mesa opinó que no debe de ser olvidada ni negada la posibilidad de tratamiento quirúrgico en la etapa aguda del infarto del miocardio.
B) Indicaciones aceptadas
La condición clínica que se acepta en forma unánime para esto, es aquella en la cual, en la etapa aguda de un infarto del miocardio se intenta realizar un procedimiento de ACTP primaria454 y este procedimiento fracasa en su intento de lograr mejorar el flujo de la arteria coronaria "culpable" del infarto o dicho procedimiento no puede ser realizado con éxito, persistiendo la condición de infarto agudo en evolución dentro de las primeras 4 horas de haberse iniciado el cuadro clínico sugestivo de infarto.457 Si bien es cierto que las características requeridas en la infraestructura hospitalaria para poder ofrecer este tipo de tratamiento no son fáciles de obtener, ya que requieren de la posibilidad de poder implementar un quirófano de cirugía cardíaca de urgencia con personal médico capacitado a cualquier hora de los 365 días del año, esta situación no es insalvable y se debe de considerar dentro de las posibilidades terapéuticas a ofrecer.458
Por otro lado, el poder realizar lo anterior es una condición que se debe de cumplir en el caso de que se ofrezca el tratamiento de un infarto agudo con la realización de una ACTP primaria, ante la eventualidad de que este procedimiento fracase.456 A esta forma de tratamiento se le estableció un nivel de evidencia IIB en el cual existen conflictos en la evidencia y las opiniones difieren pero se inclinan a favor del beneficio a los pacientes. Otra de las condiciones que se consideran requisito indispensable para poder ofrecer el tratamiento quirúrgico en la etapa aguda del miocardio es la que establece que este tratamiento se debe de ofrecer en pacientes en los cuales se haya establecido la factibilidad técnica en base a las características angiográficas de las arterias coronarias.459,460 Esto es, la cirugía debe de realizarse en pacientes con lesiones coronarias con indicación quirúrgica establecidas en la angiografía coronaria diagnóstica (Tabla XXXVII). No se puede indicar la cirugía, aún cuando el tratamiento intervencionista se haya intentado y fracasado, si las arterias distales a la lesión obstructiva no tienen las características angiográficas que las hagan ser susceptibles de la técnica de revascularización.

La condición clínica de infarto agudo el miocardio que se presenta asociado a la realización de un estudio angiográfico coronario diagnóstico durante el cual se establece una oclusión aguda o una complicación derivada del mismo, no resuelta (disección o perforación), debe de ser considerada tributaria de tratamiento quirúrgico con revascularización coronaria de urgencia (Tabla XXXVII).456,459,460
Esta circunstancia, aunque baja en porcentaje en su presentación; es una posibilidad siempre presente y obliga a tener las condiciones de infraestructura hospitalaria requeridas para poder realizar el tratamiento quirúrgico de revascularización con carácter de urgencia, dado que en el caso de que se presente esta complicación, se está ante una condición de infarto agudo del miocardio. Si a esto se suma que en el paciente que sufra esta complicación se presentan datos de deterioro hemodinámico, este hecho debe de obligar a tomar la determinación de ofrecer el tratamiento quirúrgico con revascularización coronaria con el fin de evitar una condición clínica de mayor gravedad en el paciente.461,462
C) Tronco coronario izquierdo
La tercera condición clínica en la cual la indicación quirúrgica de revascularización coronaria se establece, está en relación al diagnóstico angiográfico de una lesión crítica del tronco de la coronaria izquierda o un equivalente a ella,463 establecido por un estudio angiográfico realizado en etapa aguda de un infarto del miocardio con la intención de realizar una angiografía primaria, durante las primeras horas de establecido el cuadro clínico de infarto.
Esta condición angiográñca que limita la realización del procedimiento de ACTP primaria, debe de establecer la posibilidad de realizar la revascularización quirúrgica en la fase aguda, buscando con ello disminuir los riesgos de la evolución del infarto agudo. Si a esto se agrega la presencia de lesiones obstructivas significativas de la coronaria derecha, la indicación quirúrgica se refuerza.461,464
Aún cuando en esta aseveración hay que reconocerle un nivel de evidencia IIB, con registros observacionales contados en la literatura, es una condición clínica que debe de ser tenida en cuenta para hacer la indicación de la revascularización quirúrgica (Tabla XXXVII).
La condición hemodinámica de choque cardiogénico progresivo durante la evolución de un infarto agudo del miocardio, que obliga a realizar un estudio angiográfico que muestre lesiones obstructivas coronarias significativas a las cuales se les considere no susceptibles de ser tratadas con ACTP con la presencia de lechos arteriales distales de calidad adecuada para ser tratadas quirúrgicamente, debe de ser considerada para ser tratada con cirugía; con la intención de dar un tratamiento que cambie la historia natural de la mala evolución de los pacientes que sufren de esta grave complicación del infarto agudo del miocardio.461,463,464
En esta condición se establece un nivel de evidencia tipo IIA en el cual existe suficiente información en la literatura para saber qué es un método terapéutico que si bien puede ser sujeto a controversia, hay suficiente experiencia como para saber que hay un real beneficio para los pacientes. En el caso de que el paciente con diagnóstico de infarto del miocardio agudo continúe con síntomas o signos electrocardiográficos de angina de pecho y de isquemia del miocardio persistente, en el cual el estudio angiográfico muestre lesiones coronarias obstructivas significativas de la arteria culpable o de otras arterias coronarias no susceptibles de un tratamiento con ACTP, debe de considerarse al tratamiento quirúrgico con revascularización quirúrgica,148,150 para evitar la extensión del infarto del miocardio o la presencia de nuevos infartos en otras áreas del miocardio diferentes a las de la zona involucrada en el infarto agudo.
D) Complicaciones mecánicas
Dentro del grupo de pacientes que sufren una complicación mecánica durante la evolución de un IMEST están los que presentan:
Insuficiencia mitral por ruptura de músculo papilar. Insuficiencia mitral severa por disfunción isquémica de músculo papilar.
Perforación septal postinfarto agudo.
Ruptura de la pared libre del ventrículo izquierdo. Ruptura de la pared libre subaguda (sellada) del ventrículo izquierdo.465–467
En ellos se debe considerar la posibilidad del tratamiento quirúrgico dependiendo del compromiso hemodinámico establecido en cada una de estas complicaciones independientemente de las horas de evolución del infarto.468
En el caso de la insuficiencia mitral por ruptura o disfunción del aparato subvalvular, la consecuencia hemodinámica de hipertensión venocapilar grave o de edema pulmonar, debe de establecer la urgencia de la solución quirúrgica de la disfunción del aparato valvular mitral;469 en la valoración previa se debe de conocer la anatomía coronaria, que indicará la necesidad de realizar un tratamiento quirúrgico de revascularización asociado470 en el caso de existir lesiones obstructivas en otros territorios del árbol coronario (Tabla XXXVIII). La perforación septal postinfarto agudo, condicionante de grave deterioro hemodinámico debe de ser considerada una complicación con indicación quirúrgica de urgencia, la cual se debe de realizar independiente al tiempo de evolución del infarto del miocardio.471,472 Idealmente se deben de conocer las características anatómicas de las arterias coronarias, para ofrecer el tratamiento quirúrgico de las lesiones obstructivas asociadas; sin embargo si la condición hemodinámica se encuentra alterada en tal extremo que la búsqueda de la información angiográfica constituya un riesgo adicional de magnitud inaceptable, se deberá proceder a realizar el tratamiento quirúrgico de la perforación septal aislada, con fines de intentar cambiar la evolución de la complicación.473,474 En ese mismo sentido se debe de considerar a la complicación de la ruptura de la pared libre del ventrículo izquierdo, en la cual lo agudo de su presentación obliga a tomar determinaciones terapéuticas de urgencia, que imposibilitan la búsqueda de información angiográfica adicional.468,475 Si la evolución de la ruptura de la pared permite que se establezca una condición subaguda, con la condición de la formación de un pseudoaneurisma al haberse "sellado" con el pericardio, esto permitirá la obtención de la información angiográfica que establezca la necesidad de realizar el tratamiento quirúrgico de las lesiones coronarias asociadas.476,477 Estas condiciones tienen un sustento con un nivel de evidencia I, con la característica de que si bien existen controversias acerca de los resultados obtenidos, estas indicaciones muestran que son benéficas para los pacientes.

E) Momento quirúrgico
En lo que respeta a lo que denominamos momento quirúrgico (Tabla XXXIX) consideramos que existen tres momentos a considerar en el tratamiento quirúrgico de revascularización coronaria en IMEST.

El primero de ellos es dentro de las 6 primeras horas de haberse presentado el cuadro clínico de infarto; este período inmediato está dirigido a la recuperación de masa muscular de ventrículo izquierdo, directamente relacionado a la imposibilidad o fracaso de la realización de una ACTP primaria considerada como terapia inicial en el tratamiento del IMEST; también se relaciona a las complicaciones derivadas de la realización de un estudio diagnóstico de coronariografía o en el intento de realizar una ACTP como tratamiento de una oclusión arterial coronaria.459,463,478 El segundo momento a considerar es el de la realización de la revascularización coronaria durante las 6 a 24 horas siguientes al infarto del miocardio; en este momento quirúrgico la intención de la revascularización coronaria es contribuir a la recuperación hemodinámica en los pacientes con una evolución clínica que los lleva a sufrir una de las complicaciones asociadas a mayor mortalidad, que es el choque cardiogénico. En este tipo de pacientes es en los que el intento de revascularización muestra un cambio en la evolución natural conocida de dicha complicación y puede contribuir a mejorar las posibilidades de sobrevida.479,480
El tercer momento quirúrgico, es aquel que se debe considerar después de las primeras 24 horas de haberse presentado el infarto del miocardio y es el directamente relacionado a las complicaciones mecánicas sufridas en el ventrículo izquierdo producidas por el infarto.481,482 En estas complicaciones, es el cuadro clínico de deterioro hemodinámico grave el que indica la necesidad de realizar el tratamiento quirúrgico que busca restablecer dicha alteración hemodinámica y favorecer la sobrevida del paciente, y en el caso de la angina residual postinfarto del miocardio asociada a lesiones obstructivas coronarias graves, independientes a la de la arteria culpable del infarto, se debe de considerar la posibilidad de la revascularización coronaria con la finalidad de disminuir las posibilidades de un reinfarto en el período inmediato a la presentación del infarto agudo.459,463,465,481
F) Métodos de revascularización
De los métodos quirúrgicos de revascularización coronaria en infarto agudo del miocardio que se pueden poner a la fecha en juego existen una serie de opciones quirúrgicas que deben de ser consideradas en base a las características anatómicas de las arterias coronarias afectadas459,465,483,485 a las facilidades de infraestructura con que cuenten las instituciones hospitalarias en que se atienda a los pacientes y a la experiencia y preferencia que los grupos quirúrgicos posean.
A la fecha pueden realizarse los siguientes métodos de revascularización:
Revascularización coronaria convencional.
Revascularización coronaria sin circulación extracorpórea a corazón latiendo.
Revascularización coronaria con circulación extracorpórea a corazón latiendo. Revascularización coronaria combinada o híbrida.463,465,484–486
En cada uno de estos métodos existen ventajas y desventajas que deben de ser evaluadas por los grupos quirúrgicos en el afán de ofrecer la mejor de las opciones que se considere a favor de los pacientes.
G) Asistencia circulatoria
Otras de las participaciones que se deben de considerar en el tratamiento quirúrgico de la cirugía en el tratamiento quirúrgico en infarto del miocardio agudo es el de los métodos de asistencia circulatoria que deberán de ser puestos enjuego en relación directa al deterioro hemodinámico que se establezca por la evolución de un infarto del miocardio agudo.
De estos métodos de asistencia circulatoria, su utilización estará en función de la factibilidad de tenerlos disponibles dentro de la infraestructura hospitalaria encargada de atender al paciente con infarto agudo del miocardio.
Estos métodos son:
1. Balón intraórtico de contrapulsación.
2. Asistencia ventricular centrífuga.
3. Asistencia ventricular neumática
a) Corta duración.
b) Mediana duración.
4. Terapia definitiva.
a) Transplante cardíaco
b) Corazón mecánico
Todos estos métodos tienen indicaciones precisas, unos en el afán de favorecer la recuperación de la masa ventricular izquierda afectada por el infarto del miocardio, con el fin de mejorar la función ventricular y la sobrevida de los pacientes y otros con la finalidad de sustituir la función cardíaca deteriorada en forma definitiva con la consecuente imposibilidad de sobrevida de los pacientes.487–489
H) Conclusiones
1. La cirugía de revascularización coronaria en el infarto agudo del miocardio debe de ser considerada como una opción terapéutica válida en un grupo seleccionado de pacientes.
2. La indicación de cirugía de revascularización coronaria en infarto agudo está en relación directa a la imposibilidad o al fracaso de la realización de una ACTP primaria.
3. La cirugía de revascularización coronaria debe de considerarse como opción terapéutica en los casos en que los procedimientos diagnóstico o terapéuticos de cardiología intervencionista condicionen complicaciones que se deriven en infarto agudo del miocardio.
4. La cirugía debe de indicarse para la solución de las complicaciones mecánicas de un infarto agudo del miocardio, para mejorar las posibilidades de sobrevida en los pacientes en los que se presenten.
IX. Utilidad de estudios no invasivos
A) Generalidades
Los métodos de diagnóstico por imagen no son indispensables en la etapa aguda del infarto del miocardio, sin embargo, su aplicación es aconsejable si la condición clínica del paciente y los recursos del medio hospitalario lo permiten ya que proporcionan información sobre la localization y extensión de la zona infartada, la función ventricular, búsqueda de isquemia y de viabilidad, complicaciones del infarto o cardiopatías asociadas; la elección del método dependerá de la disponibilidad y de la experiencia de cada centro. Los estudios deberán realizarse siempre y cuando no interfieran o retrasen el tratamiento oportuno.
El ecocardiograma es un método accesible que no requiere movilización del paciente y puede repetirse cuantas veces sea necesario, dependiendo de las complicaciones del infarto; permite conocer el resultado del tratamiento, valorar la evolución y realizar estratificación del pronóstico.490 Proporciona información anatómica y hemodinámica, la primera a través de las imágenes bidimensionales de ambos ventrículos y la segunda a través del Doppler cardíaco el cual permite además la valoración de la función diastólica (Tabla XL). En presencia de limitaciones para obtener información ecocardiográfica completa a través de registros transtorácicos se puede recurrir al ecocardiograma transesofágico, aunque en la actualidad la utilización de armónicas y agentes ecorrealzadores han mejorado la calidad de las imágenes.491 En la Tabla XL se resumen las principales indicaciones de la ecocardiografía.
La utilidad de la cardiología nuclear se ve limitada en la etapa inicial por aspectos relacionados con la movilización del paciente fuera de la unidad de urgencias o de cuidados coronarios. En cambio es muy útil durante la estancia hospitalaria, proporcionando información complementaria sobre el estado de la perfusión miocárdica y la función biventricular, permitiendo la toma de decisiones terapéuticas y estratificación del riesgo492 (Tabla XLI).


La resonancia magnética ofrece grandes expectativas ya que también brinda información sobre perfusión, viabilidad y es actualmente el estándar de referencia para el cálculo de volúmenes y función sistólica, destacando su buena resolución anatómica que inclusive promete información sobre la visualization del árbol coronario y la placa ateroesclerosa493 sin embargo, su elevado costo y poca disponibilidad obligan a la racionalización de su uso. Su utilidad como método para el diagnóstico de síndromes coronarios agudos está en estudio.494,495
La tomografía helicoidal de multidetectores es una técnica que permite la cuantificación de calcio coronario como dato de ateroesclerosis, además de la realización de angiografía coronaria no invasiva.496 La detección de calcio coronario es predictora de eventos coronarios futuros en poblaciones asintomáticas, identificando individuos que ameritan una intervención temprana. Su papel en los síndromes coronarios agudos está limitado por un bajo nivel de evidencia. Por otra parte, la angiografía coronaria con tomógrafo multi–detector requiere equipos de al menos 16 detectores, lo cual limita su disponibilidad en nuestro medio. A pesar de ello debe tomarse en cuenta como un arma de diagnóstico a aplicarse en el futuro.
En la Tabla XLI se resumen las principales aplicaciones de la cardiología nuclear y la resonancia magnética nuclear.
b) Evaluación de movilidad
La valoración de la función sistólica del ventrículo izquierdo puede ser global a través de la medición de la fracción de eyección y del gasto cardíaco, o segmentaria calificando la movilidad de cada uno de los segmentos propuestos por las sociedades internacionales, los cuales están estandarizados para los diferentes métodos de imagen no invasiva (Fig. 7)497,497a,497b Para calificar la movilidad mediante ecocardiografía y resonancia magnética se sugiere la siguiente escala:
• 1 Normal
• 2 Hipoquinesia
• 3 Aquinesia
• 4 Discinesia
• 5 Aneurisma
Para calificar la perfusión en medicina nuclear497c se utiliza una escala de cinco puntos como sigue:
• 0 Perfusión normal
• 1 Defecto ligero
• 2 Defecto moderado
• 3 Defecto severo
• 4 Ausencia de perfusión
En la Tabla XLII se enumeran las principales aplicaciones de todos lo anteriores métodos no invasivos, así mismo la utilidad que tienen para la estratificación de riesgo al alta hospitalaria de los pacientes con infarto agudo del miocardio.

X. Manejo al alta hospitalaria
A) Generalidades
El manejo al alta hospitalaria del paciente con infarto con onda "Q" debe individualizarse tomando en cuenta los siguientes factores:
Características biológicas, psicológicas y sociales del paciente, magnitud y severidad del infarto. El daño y la repercusión funcional producidos por el infarto y el tipo de manejo o procedimientos realizados. El primer paso para decidir el alta hospitalaria de un paciente que sufrió infarto del miocardio es establecer su nivel de riesgo, (Fig. 8) para poder decidir si requiere procedimientos diagnósticos o terapéuticos adicionales antes de ser externado o a corto plazo, o bien si puede ir a casa con recomendaciones sobre su estilo de vida y/o manejo médico exclusivamente.
B) Estratificación de riesgo al alta
Las siguientes condiciones ubican al paciente en el grupo de alto riesgo y entre mayor número de ellas coexistan, mayor será su riesgo:
• Infarto en cara anterior
• Infarto previo
• Edad mayor de 70 años
• Diabetes mellitus
• Género femenino
• Angina residual
• Fracción de expulsión < 40%
• Inestabilidad eléctrica ( > 10 ESV/hr)
• Hipotensión arterial y/o taquicardia sinusal
• Datos de ICC
• Fibrilación auricular de aparición durante el evento agudo
Una vez realizados los procedimientos diagnósticos y terapéuticos requeridos y que el paciente va a su domicilio, debe establecerse un programa terapéutico a corto y mediano plazo para modificar los factores de riesgo cardiovascular, debiendo contener al menos los siguientes elementos (Tablas XLIII y XLIV).

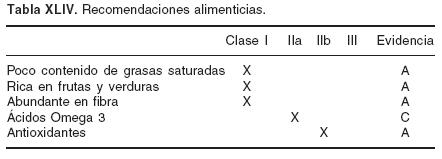
• Educación para estilo de vida sana
• Supresión de hábitos nocivos (tabaquismo, alcoholismo, sedentarismo)
• Tratamiento farmacológico de enfermedades coexistentes (diabetes, hipertensión, dislipidemias, hiperuricemia, obesidad, resistencia a la insulina, etc.)
• Soporte psicológico que permita su reintegración a la vida ordinaria.
• Programa de rehabilitación cardiovascular.
• Detección de riesgo y educación en familiares directos del paciente.
Es importante enfatizar la necesidad de lograr las metas terapéuticas establecidas para cada uno de los elementos considerados en la tabla anterior, ya que de acuerdo a las evidencias clínicas obtenidas de estudios prospectivos, aleatorizados y cegados, si no se logran las metas, no se obtiene el beneficio buscado con dicha intervención (ver lineamientos para el manejo de dislipidemias, hipertensión arterial, diabetes, resistencia a la insulina y obesidad).498,499
El soporte psicológico tendiente a disminuir la ansiedad del paciente, en especial en aquellos con personalidad primaria, es una intervención que frecuentemente se olvida y por ende el paciente se ve privado de su beneficio.500
Quizá uno de los factores más difíciles de modificar es el hábito alimentario particular de cada paciente, pero es importante hacerlo, ya que es una de las intervenciones que ha demostrado mayor beneficio, dada la influencia que tiene sobre los demás factores de riesgo, tales como lípidos, glucemia, resistencia a la insulina, obesidad, hipertensión arterial, etc.
Dentro del estilo de "vida sana", la ingesta de una dieta "sana", pobre en grasas saturadas, rica en frutas y en fibras vegetales (dieta mediterránea) tiene el nivel más alto de evidencia para prevenir tanto la aparición de nuevos eventos cardiovasculares, como la muerte,501 no así el uso de los ácidos Omega 3502 y los antioxidantes, cuyo nivel de evidencia en prevención secundaria hacen que no se justifique su indicación en forma generalizada y deberán en caso requerido, utilizarse sólo en aquellas pacientes cuyas condiciones comórbidas lo justifiquen.503 Otra de las intervenciones consideradas como "eje" para la reducción del riesgo cardiovascular es el ejercicio aeróbico, ya que al igual que la de dieta sana, coadyuva al control eficaz de la mayoría de los demás factores de riesgo, tales como la dislipidemia, la obesidad, la hipertensión arterial, los niveles de glucemia, la resistencia a la insulina y por ende mejora la función endotelial, logrando reducciones de mortalidad hasta de 14% ,504
C) Rehabilitación cardiovascular
La rehabilitación cardiovascular juega un papel decisivo en el asesoramiento del paciente para realizar ejercicio sin riesgo y con el máximo beneficio.505
En programa de rehabilitación debe adecuarse al nivel de riesgo y capacidades del paciente. El hábito de fumar es el principal factor de riesgo para recurrencias de infarto del miocardio fatal y no fatal.506 El suspender el hábito tabáquico reduce hasta 50% el riesgo de sufrir un nuevo evento cardiovascular en los pacientes que dejan de fumar, respecto de aquellos que lo siguen haciendo507–509y los programas institucionales formales han demostrado beneficios sustanciales.510 El uso de terapia sustitutiva de nicotina ha demostrado ser una herramienta útil para dejar el hábito de fumar, en especial para aquellos fumadores de más de 10 cigarros al día.511 Considerando el costo/ beneficio de todas las intervenciones tendientes a reducir el riesgo cardiovascular, sin lugar a dudas, el estilo de vida sana, englobado en dieta sana, ejercicio aeróbico rutinario (caminata, natación o bicicleta) y la supresión de hábito de fumar en caso de existir el hábito, son los procedimientos más económicos y con mayor impacto en la reducción de la morbi–mortalidad cardiovascular en prevención secundaria, además del beneficio que sobre la población sana ejerce al convertirse en ejemplos de "vida sana". En muchas ocasiones no es suficiente el modificar el estilo de vida del paciente, requiriendo el uso de fármacos para prevenir la progresión, favorecer la regresión de las alteraciones existentes y/o evitar la aparición de nuevas condiciones que aumenten el riesgo cardiovascular. En la Tabla XLV se ennumeran las principales indicaciones de la rehabilitación cardíaca.

D) Manejo farmacológico
La Tabla XLVI resume las principales intervenciones terapéuticas farmacológicas con su nivel de indicación, en los pacientes que han sufrido un infarto agudo del miocardio y serán egresados a su domicilio.

1. Antiagragantes plaquetarios
El uso de antiagregantes plaquetarios en prevención secundaria, en especial la aspirina a dosis de 75–325 mg/día en pacientes post–infarto del miocardio es la intervención farmacológica que ha demostrado mejores resultados al evaluar su costo–beneficio, siendo su impacto paralelo al nivel de riesgo o severidad del problema cardiovascular del paciente, especialmente en presencia de diabetes mellitus, hipertensión arterial o insuficiencia cardíaca.512,513 La aspirina pues, debe utilizarse en todo paciente que haya sufrido un IAM por tiempo indefinido, en ausencia de contraindicaciones. El clopidogrel, ha demostrado ser útil para la prevención secundaria en el subgrupo de pacientes con IAM sin elevación del ST195,513a o en forma temporal en pacientes con intervención coronaria, ya sea solo o en combinación con aspirina.499 Con los resultados de los estudios CLARITY200a y COMMIT existe evidencia suficiente para recomendar su uso rutinario en pacientes con IMEST. El dipiridamol no debe utilizarse en el infarto. En la Tabla XLVII se resumen las principales indicaciones de los antiagregantes plaquetarios.

2. Anticoagulantes orales
Los anticoagulantes orales en la era pre–aspirina mostraron un beneficio evidente en pacientes con IAM,514,515 sin embargo, al ser comparados con la aspirina no demuestran superioridad y sí incrementan riesgos, motivo por el cual no deben ser utilizados en forma generalizada, sin embargo, algunos subgrupos de pacientes deben de ser considerados para su uso "rutinario", como aquellos con infartos anteriores extensos o con trombo intracavitario o bien, aquellos pacientes con fibrilación auricular permanente.516,517 La combinación de aspirina más anticoagulantes no es mejor, en términos de mortalidad que la aspirina sola,518,518a,519 sin embargo, existe cierta superioridad de esta combinación al reducir la incidencia de reinfartos, pero con un incremento de eventos hemorrágicos mayores.520,521 En la Tabla XLVIII se ennumeran las principales indicaciones para el uso de anticoagulantes orales.

3. Betabloqueadores
Todo paciente con IAM debe de recibir un betabloqueador, de preferencia cardioselectivo, de no existir contraindicaciones para su uso. Numerosos estudios aleatorizados han demostrado que el uso de betabloqueadores reduce hasta en un 25% la mortalidad y la incidencia de reinfarto en este tipo de pacientes.62,522,523 El uso de betabloqueadores en el postinfarto522a,522b,522c debe de ser por tiempo indefinido y en todos los pacientes que no tengan contraindicación, incluyendo a grupos especiales, como el paciente reperfundido, el paciente con falla ventricular o aquél que se encuentra en tratamiento con otros grupos farmacológicos, tales como antiagregantes plaquetarios o inhibidores de la enzima de conversión229 (Tabla XLIX). Las únicas contraindicaciones absolutas para el uso de betabloqueadores en el postinfarto del miocardio son: a) evidencia de broncoespasmo, b) Bloqueo auriculoventricular avanzado y la bradicardia extrema, sin embargo, en estos dos últimos casos, el uso de marcapaso definitivo deberá ponderarse para poder administrar el beta–bloqueador.

4. Calcioantagonistas
Los calcioantagonistas del grupo de las dihidropiridinas, no representan un recurso terapéutico de facto en pacientes con IAM, incluso, su uso puede ser deletéreo en términos de pronóstico235,524 (Recomendación clase III), sin embargo, el verapamil y el diltiazem, pueden ser considerados solamente cuando los β–bloqueadores se encuentren claramente contraindicados525,526 (Recomendación clase IIb).
5. Nitratos
No existe evidencia que los nitratos mejoren la morbimortalidad de los pacientes que han sufrido un infarto del miocardio,55,56 sin embargo continúan siendo un medicamento valioso, sólo en pacientes con angina residual (Recomendación clase IIa).
6. Inhibidores de la enzima de conversión (IECA)
Los IECAS son uno de los grupos terapéuticos que mayor beneficio han demostrado en el tratamiento del paciente postinfarto del miocardio, al reducir la disfunción ventricular y la progresión hacia la insuficiencia cardíaca al evitar la remodelación patológica del ventrículo izquierdo. En pacientes con disfunción ventricular, los IECAS disminuyen la mortalidad y otros eventos adversos a mediano plazo entre 19 y 29%.427,527,528 Actualmente, su indicación es obligada en todo paciente con IAM y una fracción de expulsión menor del 40%529 (Recomendación clase I nivel de evidencia A). El Estudio EUROPA aún no publicado, demuestra el beneficio del uso de los IECAS en todos los pacientes postinfarto del miocardio independientemente del valor de su función ventricular residual. Los pacientes diabéticos se ven especialmente favorecidos con la utilización de los IECAS.530 En resumen, los IECAS deben ser administrados a todo paciente postinfartado, a menos que exista contraindicación (hipotensión severa o sintomática, insuficiencia renal moderada e hipercalemia), todo paciente con IAM debe recibir un IECA en adición a un betabloqueador y aspirina (Tabla L). En los pacientes con intolerancia a los IECAS, los antagonistas del receptor de la angiotensina II (ARA II) representan una alternativa muy interesante, la cual inicia su era de evaluación sistemática en estos pacientes.

7. Antagonistas de aldosterona
La aldosterona juega un papel importante el la patofisiologia de la insuficiencia cardíaca ya que promueve la retención de sodio, la pérdida de magnesio, la activación del sistema simpático, la inhibición del parasimpático, fibrosis miocárdica y vascular, disfunción de los barorreceptores, daño vascular y alteraciones de la complianza arterial. El bloqueo de la misma reduce la tasa de muerte por falla cardíaca progresiva, muerte súbita y la tasa de hospitalizaciones en pacientes con disfunción sistólica del VI que están siendo tratados con IECA's.531 El bloqueo de la aldosterona también previene de la remodelación ventricular y la formación de colágeno en pacientes con disfunción del ventrículo izquierdo después de un infarto agudo al miocardio.532 También se afecta un número de mecanismos fisiopatológicos que se piensa son importantes en el pronóstico de pacientes con infarto agudo al miocardio.533 El estudio RALES,531 enroló 1,663 pacientes con insuficiencia cardíaca severa con FE de nos más 35% quienes estaban tomando IECAS, diurético de asa y la mayoría digoxina. Un total de 822 pacientes fueron asignados para recibir espironolactona 25 mg diarios y 821 paciente para recibir placebo. El punto final primario fue muerte por cualquier causa. El estudio fue terminado de forma temprana ya que un análisis intermedio mostró la eficacia de la espironolactona. Hubo 386 muerte en el grupo placebo (46%) y 284 muertes en el grupo con espironolactona (35%) con un riesgo relativo de muerte de 0.70 y una p de 0.001. EL estudio EPHESUS534 se diseñó para probar la hipótesis de que la eplerenona (un bloqueador de la aldosterona que va a inhibir selectivamente el receptor mineralocorticoide) reduce la mortalidad total y la mortalidad por causas cardiovasculares y/o hospitalización por eventos cardiovasculares en pacientes con infarto agudo al miocardio en tratamiento médico óptimo complicados con disfunción del ventrículo izquierdo y falla cardíaca. En este estudio se aleatorizaron 6,632 pacientes de los cuales 3,313 pacientes recibieron 25 a 50 mg de eplerenona y 3,319 pacientes recibieron placebo junto con tratamiento médico óptimo. Durante el seguimiento a 16 meses se encontró que hubo 478 muertes en el grupo de la eplerenona y 554 en el grupo placebo (riesgo relativo 0.85% p = 0.0008), la gran mayoría por causas cardiovasculares. La tasa de otros eventos adversos primarios fue reducida por la eplerrenona así como también la muerte por cualquier otra causa. Por lo tanto, se concluye que la adición de eplerrenona al tratamiento médico óptimo reduce la morbilidad y mortalidad en pacientes con infarto agudo al miocardio complicado con disfunción del ventrículo izquierdo y falla cardíaca534 (Tabla XLVI).
8. Fármacos hipolipemiantes
El logro de las metas en el nivel sérico de colesterol y en especial de las LDL–col, ha sido una de las intervenciones que más reducen la morbimortalidad cardiovascular en los pacientes postinfartados. Los fármacos hipolipemiantes, en especial las estatinas, han demostrado ser la mejor estrategia terapéutica para el logro de estas metas,535–537 reduciendo la mortalidad cardiovascular del 24 al 30%, incluso en pacientes con valores normales de colesterol LDL, pacientes diabéticos y ancianos,538 atribuyendo su efecto benéfico a los efectos pleiotrópicos de las estatinas sobre la función endotelial, la respuesta inflamatoria, la estabilización de la placa y sus propiedades antitrombóticas.51,538a Todo paciente con IAM y LDL–col > 100 mg/ dL debe recibir una estatina como tratamiento integral, aunque cada día se extiende la evidencia para su uso en todos los pacientes con síndrome coronario agudo independientemente de su perfil lipídico.539 En el estudio MIRA–CL68 se incluyeron pacientes con angina inestable o infarto agudo al miocardio a los cuales se les administró atorvastatina 80 mg diarios 24 a 96 horas después del síndrome isquémico coronario agudo. Se enrolaron 228 pacientes para recibir atorvastatina y 269 pacientes para recibir placebo. El punto final primario fue muerte, infarto al miocardio no fatal, paro cardíaco e isquemia miocárdica recurrente. Aunque no hubo diferencias en el riesgo de muerte, infarto miocárdico no fatal y paro cardíaco entre el grupo de atorvastatina y el grupo de placebo, el grupo de atorvastatina tuvo una menor incidencia de isquemia recurrente sintomática que requiriese hospitalización con una p de 0.02.
En el estudio PROVE IT540 se enrolaron 4,162 pacientes con síndrome isquémico coronario agudo, y se compararon 40 mg de pravastatina diarios (terapia estándar) con 80 mg de atorvastaina diarios (terapia intensiva). El punto final primario compuesto fue muerte de cualquier causa, infarto al miocardio, angina inestable que requirió hospitalización, revascularización y EVC. A dos años de seguimiento, el punto final primario compuesto fue de 26.3 por ciento en el grupo con pravastatina y 22.4% en el grupo con atorvastatina con una p de 0.005. En el estudio A to Z,541 se comparó una estrategia intensiva de 80 mg de simvastatina en 2,265 pacientes vs una estrategia conservadora de 20 mg de simvastatina en 2,232 pacientes, todos ellos con síndrome coronario agudo. Los puntos finales fueron muerte cardiovascular, infarto no fatal, rehospitalización por síndrome coronario agudo y EVC, observándose en el 16.7% del grupo de dosis conservadora vs el 14.4% en el grupo de estrategia intensiva p NS. Finalmente en el estudio REVERSAL542 se compararon regímenes diseñados para producir una disminución intensa de los lípidos (atorvastatina 80 mg diarios) y una disminución moderada de los lípidos (pravastatina 40 mg diarios), sobre las placas de ateroma en arterias coronarias y su progresión. Se utilizó el ultrasonido intracoronario para medir la placa de ateroma. El parámetro primario de eficacia fue el porcentaje de cambio del volumen de ateroma a los 18 meses de seguimiento. Los paciente con atorvastatina mostraron una tasa baja de progresión comparado con el grupo con pravastatina con una p de 0.02. Por lo anterior se recomienda iniciar el manejo con atorvastatina 80 mg en el segundo o tercer día del infarto y mantenerlo por al menos 12 meses; posterior a ese tiempo quedará a criterio del clínico la selección de la estatuía adecuada para alcanzar las metas del ATPIII.
El uso de las estatinas deberá ser indefinido en caso de no presentarse efectos adversos ya que los beneficios se han comprobado hasta por 6 años de seguimiento (Tabla LI). La combinación de fármacos hipolipemiantes deberá tomarse en cuenta cuando los niveles de LDL sean superiores a 70 mg/dL; la combinación más segura y efectiva es la asociación de estatina más ezetimiba. Precauciones especiales (daño muscular) se deberán de tomar en cuenta cuando una estatina se asocia a un fibrato. Se encuentra en proceso el estudio IMPROV–IT, que compara la utilización de simvastatina + ezetimiba vs simvastatina a dosis altas en pacientes con IMEST. En caso de contraindicación formal a la administración de una estatina, los fibratos deberán de considerarse, especialmente cuando existan niveles disminuidos de HDL543 o los triglicéridos elevados.538,544

E) Algoritmo de Estratificación Pre–alta
En la Fig. 8, se describe el abordaje para la estratificación de riesgo al alta del paciente con IMEST, tanto en aquellos con intervención exitosa, como en los no intervenidos o con resultados subóptimos o fallidos.
En la Tabla LII se enumeran las principales características e indicaciones de la prueba de esfuerzo al alta del paciente.

AC= Angiografía coronaria
ACTP= Angioplastía coronaria transluminal percutánea
AI= Angina inestable
ARN= Angiografía radionuclear
AAS= Ácido acetilsalicílico
AVISA= Años de vida saludable
BM= Biomarcadores
BRIHH= Bloqueo de la rama izquierda del haz de His
CK–MB= Creatin–quinasa ligada al miocardio (miocardial–bound)
CPK= Creatin–foso–quinasa
2D= Bidimensional
DHL= Deshidrogenasa láctica
ECG=Electrocardiograma(s);electrocardiográfico(s)
FC= Frecuencia cardíaca
FE= Fracción de expulsión
GP= Glicoproteínico(s)
GRACE= Global Registry of Acute Coronary Events
HBPM= Heparina de bajo peso molecular
IAM= Infarto agudo del miocardio
ICP= Intervención coronaria percutánea
IECA= Inhibidores de la enzima convertidora de angiotensina
IGPI b/IIIa= Inhibidores de las glucoproteínas IIb/IIIa
IMEST= Infarto del miocardio con elevación del ST
IMNEST= Infarto del miocardio sin elevación del ST
IMN= Imagen de medicina nuclear
MC= Marcador(es) cardíaco(s)
MMP= Matriz metalo–proteinasa(s)
MN= Moneda nacional
OMS= Organización Mundial de la Salud
PAI–1 y 2= Inhibidores de la activación del plasminógeno
RMN= Resonancia magnético nuclear
SCA= Síndromes coronarios agudos
TA= Tensión arterial
TAS= Tensión arterial sistólica
TC= Troponinas cardíacas
TF= Factor tisular (tissue factor)
TF=Terapia fibrinolítica
t–PA= Activador tisular del plasminógeno (tissue PA)
u–PA= Uroquinasa (urine PA)